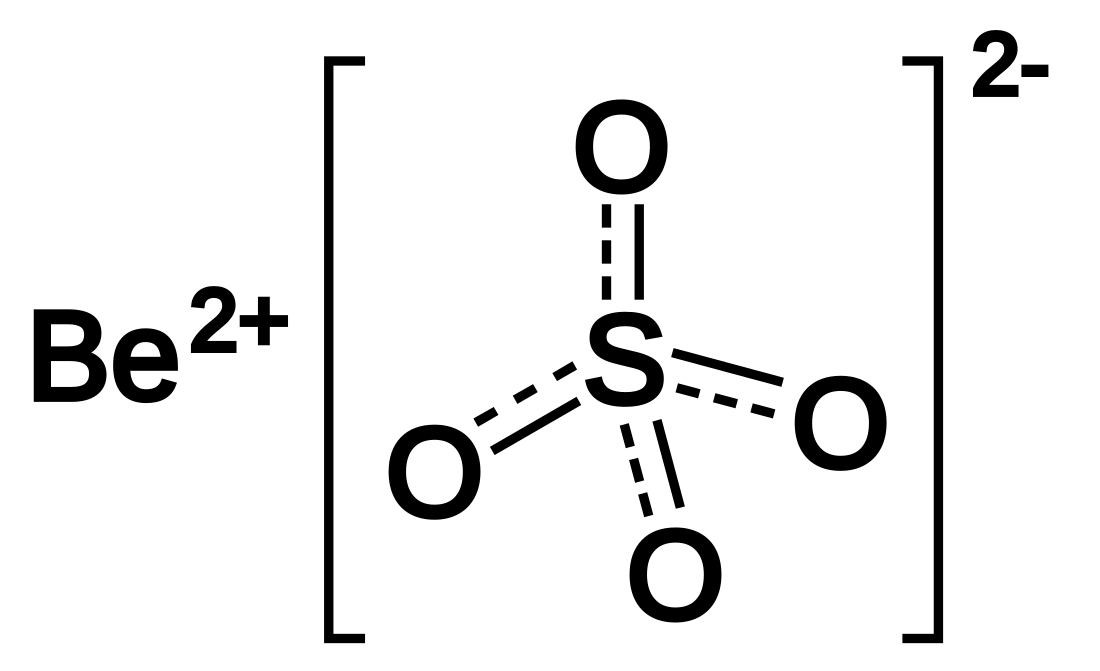
硫酸鈹是一種無機化合物,化學式為BeSO4,它通常以四水合物[Be(H2O)4]SO4的形式存在,為無色晶體。硫酸鈹最早於1815年被永斯·貝采利烏斯發現。[3] 硫酸鈹易溶於水,微溶於濃硫酸。[4]
| 硫酸鈹 | |
|---|---|
| |

| |
| 識別 | |
| CAS號 | 13510-49-1(無水) 7787-56-6(四水) |
| PubChem | 26077 |
| ChemSpider | 24291 |
| SMILES |
|
| InChI |
|
| InChIKey | KQHXBDOEECKORE-NUQVWONBAA |
| EINECS | 236-842-2 |
| ChEBI | 53473 |
| RTECS | DS4800000 |
| 性質 | |
| 化學式 | BeSO4 |
| 摩爾質量 | 105.075 g/mol(無水) 177.136 g/mol(四水) g·mol⁻¹ |
| 外觀 | 白色固體或無色晶體 |
| 氣味 | 無味 |
| 密度 | 2.44 g/cm3(無水) 1.71 g/cm3(四水) |
| 熔點 | 110 °C(383 K)(四水合物,−2H2O) 400 °C(673 K)(二水,完全失水) 550—600 °C(823—873 K)(分解) |
| 沸點 | 2,500 °C(2,770 K)(無水) 580 °C(853 K)(四水) |
| 溶解性(水) | 36.2 g/100 mL (0 °C) 40.0 g/100 mL (20 °C) 54.3 g/100 mL (60 °C) |
| 溶解性 | 難溶於乙醇 |
| 折光度n D |
1.4374(四水) |
| 熱力學 | |
| ΔfHm⦵298K | -1197 kJ/mol |
| S⦵298K | 90 J/mol K |
| 危險性 | |
GHS危險性符號  
| |
| GHS提示詞 | 危險 |
| H-術語 | H350, H330, H301, H372, H319, H335, H315, H317, H411 |
| 閃點 | 不可燃 |
| PEL | TWA 0.002 mg/m3 C 0.005 mg/m3 (30分鐘), 峰值為0.025 mg/m3 (以Be計)[1] |
| 致死量或濃度: | |
LD50(中位劑量)
|
82 mg/kg (大鼠,經口) 80 mg/kg (小鼠,經口)[2] |
| 相關物質 | |
| 其他陽離子 | 硫酸鎂 硫酸鈣 硫酸鍶 硫酸鋇 |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
製備及結構
硫酸鈹可以由其它鈹化合物和硫酸反應,蒸發溶液後結晶得到。水合物在400 °C加熱得到無水物。[5]四水合物有四面體的Be(OH2)42+單元和硫酸根離子。Be2+陽離子的半徑小,使配位水分子的數量比同族MgSO4·6H2O中的Mg(OH2)62+配離子的配位水數目少。[6]
無水物的結構和塊磷鋁礦的結構類似,結構中四面體配位的Be和S原子交替排布,每個氧為二配位(Be-O-S)。分子中Be-O的鍵長為156 pm;S-O的鍵長為150 pm。[7]
性質及用途
- BeSO4 → BeO + SO3
參考文獻
拓展連結
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.