鉛化合物是含鉛元素的化合物,在這些化合物中,鉛主要呈現+2和+4價,其中+2價更穩定。無機的四價鉛化合物是強氧化劑。[1]鉛的含氧酸鹽大都是無色或白色的,低價氧化物和碘化物有着鮮艷的顏色,二氧化鉛和硫化鉛都是黑色的固體。




鉛化合物的化學性質
多種鉛化合物能夠很容易地被還原為單質。如一氧化鉛(PbO)在加熱的時候可以被溫和的有機還原劑(如葡萄糖)還原。一氧化鉛和硫化鉛共熱,也能得到金屬鉛。[2]
- 2 PbO + PbS → 3 Pb + SO2
金屬鉛暴露於空氣中,表面會形成一層緻密的薄膜(含氧化鉛和鹼式碳酸鉛)以阻止向金屬內部的進一步氧化反應。鉛在硫酸和鹽酸中較為穩定,但是能溶於硝酸,形成硝酸鉛並放出一氧化氮:
- 3 Pb + 8 H+ + 8 NO−
3 → 3 Pb2+ + 6 NO−
3 + 2 NO + 4 H2O
鉛和鹼金屬硝酸鹽共熱,可以產生一氧化鉛(俗稱密陀僧),硝酸鹽則被還原為亞硝酸鹽。一氧化鉛可溶於硝酸和乙酸,形成的溶液能夠沉澱出微溶或難溶於水鹵化物、硫化物、硫酸鹽、碳酸鹽和鉻酸鹽。在鹵化物中,碘化物的溶解性比溴化物小,溴化物的溶解性比氯化物小。[3]
Pb+NaNO3–>PbO+NaNO2
氧化鉛溶解在鹼金屬氫氧化物溶液中,形成亞鉛酸鹽。亞鉛酸鹽和氯氣反應,可以得到二氧化鉛,其中鉛為+4價:[2]
- PbO + 2 OH− + H2O → Pb(OH)2−
4 - Pb(OH)2−
4 + Cl2 → PbO2 + 2 Cl− + 2 H2O
二氧化鉛是+4價鉛化合物的一個代表,它是一種強氧化劑。而+4價鉛的氯化物PbCl4則很不穩定,容易分解為PbCl2並放出氯氣。+4價鉛的溴化物和碘化物仍屬未知。[3]二氧化鉛溶解在鹼金屬氫氧化物溶液中,形成相應的鉛酸鹽。[2]
- PbO2 + 2 OH− + 2 H2O → Pb(OH)2−
6
鉛的另一種氧化物四氧化三鉛(Pb3O4)是混合價態氧化物,同時含有+2和+4價鉛。
氧化物和硫化物

鉛有多種氧化物,其中PbO、Pb3O4和PbO2是最常見的三種氧化物。PbO有兩種結構:α-PbO和β-PbO,這兩種氧化鉛都具有層狀結構,鉛原子都是四配位的。α-PbO是紅色固體,Pb–O鍵長為230 pm;β-PbO是黃色固體,Pb–O的鍵長為221和249 pm(不對稱的結構產生了兩種鍵長)。[5]由於兩種結構的相似性,它們都能在標準狀態下存在(其中β-PbO含有痕量(10−5)的雜質,如Si、Ge、Mo等)。PbO和酸反應形成鹽,和鹼反應生成[Pb(OH)3]−和[Pb(OH)4]2−。[6]
二氧化鉛可以由鉛鹽和鹵素作用產生。α型屬於三方晶系,β型屬於四方晶系。[6]兩種形態均是棕褐色固體,含有無法失去的水,加熱二氧化鉛會使其分解為一氧化鉛或四氧化三鉛。二氧化鉛是一種強氧化劑,可以氧化鹽酸和硫酸,分別放出氯氣和氧氣。它和強鹼反應,生成羥基鉛(IV)酸鹽,和鹼性氧化物反應,生成鉛(IV)酸鹽。[6]
鉛和硫或硫化氫反應,生成硫化鉛。硫化鉛屬於NaCl晶型,簡單立方結構,因而有着高熔點(1114℃)。在空氣中加熱硫化鉛,會得到一氧化鉛和硫酸鉛。[7]硫化鉛難溶於水、弱酸、硫化銨或多硫化銨溶液,這使得它在無機定性分析中和錫、砷、銻等元素分離。硫化鉛可溶於硝酸和濃鹽酸,分別生成硫和硫化氫。[7]硫化鉛和一氧化鉛共熱,可以得到金屬鉛:[2]
- 2 PbO + PbS → 3 Pb + SO2↑
鉛是ⅣA族中唯一能形成穩定的硫醇鹽的元素,硫醇(R−SH)和鉛(II)鹽反應,可以生成黃色的硫醇鉛沉澱。硫醇鉛易被氧化:[8]
- (RS)2Pb + I2 → R2S2 + PbI2
鹵化物


在氟化氫中加熱碳酸鉛,可以得到氟氫化物,熔融時產生氟化鉛。氟化鉛是白色晶體,比碘化鉛更易溶,但比氯化鉛和溴化鉛難溶。氟化鉛不能形成氟配位的化合物(PbF+陽離子除外)。[9]四氟化鉛是黃色晶體粉末,不穩定。
其它二鹵化物可以由鉛(II)鹽和其它金屬的鹵化物共熱得到,沉澱法或單質化合法亦可。這些鹵化物屬於正交晶系,其溶解度隨着溫度的升高而變大,向溶液中加入鹵化物會先降低其溶解度,之後由於形成配合物(最大配位數為6),溶解度再次增高。配合物的種類取決於離子濃度、鹵化物中鹼金屬的原子序數、鹵化物的種類、反應溫度及離子強度等因素。[10]四氯化鉛可以由二氧化鉛溶於濃鹽酸得到,易分解。氫溴酸和氫碘酸與二氧化鉛反應,只會得到二鹵化物及氧化產生的鹵素單質。[11]二砹化鉛也有報道。[12]
鉛可以形成一系列的氯配合物,25 °C時,它們的平衡常數如下:[13]
- Pb2+ + Cl− → PbCl+, K1 = 12.59
- PbCl+ + Cl− → PbCl2, K2 = 14.45
- PbCl2 + Cl− → PbCl3−, K3 = 3.98 ×10−1
- PbCl3− + Cl− → PbCl42−, K4 = 8.92 × 10−2
含氧酸鹽

鉛與硫酸或鹽酸無明顯作用,但是可以溶解在硝酸中,生成硝酸鉛(Pb(NO3)2)並放出一氧化氮。[9]硝酸鉛易溶於水,但在硝酸溶液中的溶解度較低。硝酸鉛於相應的陰離子反應,可以沉澱出鹵化鉛、硫酸鉛、鉻酸鉛、碳酸鉛或鹼式碳酸鉛等物質。[3]硝酸鉛於1597年首次在文獻中被描述,德國人安德烈亞斯·利巴菲烏斯在文獻中稱之為「甜蜜的鉛」,這源於硝酸鉛嘗起來的味道。[15]
乙酸鉛(Pb(CH3COO)2)又稱醋酸鉛、鉛糖,鉛糖一名也源於其甜味,過去曾作為甜味劑,後來人們發現食入乙酸鉛會導致鉛中毒,政府便禁止了這一添加劑。[16]乙酸鉛和硫化氫反應,可以產生黑色的硫化鉛,根據這一性質,乙酸鉛製作為試紙被用於檢測硫化氫的存在。
鹼式碳酸鉛(Pb3(OH)2(CO3)2)又稱鉛白、C.I.顏料白1,曾在19世紀被當作白色顏料使用。[17]由於鉛白具有毒性,這一白色顏料逐漸被鈦白(TiO2)替代。[18]另一種含鉛顏料是鉻黃,成分是鉻酸鉛(PbCrO4)。鉻酸鉛可由鉻酸鈉和硝酸鉛反應,沉澱得到。它最早於19世紀20年代作為黃色顏料使用。[19]這種物質的缺點除了有毒外,它在空氣中會變暗[20],後來被另一種稱作「鎘黃」的顏料所代替。[21]
鉛化合物扮演的另一個角色便是炸藥,除了硝酸鉛合劑外,苦味酸鉛是又一知名的爆炸品。它由苦味酸鹽和可溶性鉛鹽反應,沉澱得到。苦味酸鉛對撞擊敏感,2 kg的物體從2 cm高處落下即可引爆。[22]
有機鉛化合物
最著名的有機鉛化合物是鉛烷衍生物四甲基鉛(TML)和四乙基鉛(TEL),而六乙基二鉛(HEDL)的穩定性就較差,這些化合物中含Pb(IV),Pb–C鍵為共價鍵。因此它們是典型的有機鉛化合物。[23]
鉛和鈉形成1:1的合金,與烷基鹵化物反應,生成有機鉛化合物,如四乙基鉛。[24]在四甲基鉛和四乙基鉛中的Pb–C鍵鍵能分別只有167和145 kJ/mol,數據表明這些化合物受熱分解。四乙基鉛在100 °C(373 K)開始分解,熱解產物是單質鉛和烷基自由基,它們的相互作用可以產生六乙基二鉛。[23]這些化合物在日光或紫外線下也能分解。[25]在氯的存在下,烷基可以被氯取代;在HCl的存在下(前者反應的副產物),R2PbCl2可以完全轉變為無機物PbCl2。烷基鉛和溴的反應類似。[25]四甲基鉛和二氧化硫在水的存在下反應,生成(CH3)2PbSO3;和三氧化硫在潮濕的1,2-二氯乙烷中反應,生成(CH3)2PbSO4;和四氧化二氮在戊烷中反應,生成(CH3)3PbNO3,但在三氯甲烷中反應,生成[(CH3)2Pb(cis-(CH3NO)2)](NO3)2。[26]
環戊二烯基鈉和硝酸鉛反應,生成鉛的環戊二烯配合物二茂鉛,它可溶於苯、丙酮、乙醚等有機溶劑,難溶於水,但在冷水中穩定。[27]
四乙酸鉛和芳香烴反應,可以直接得到有機鉛化合物,如和苯甲醚的反應:[28]
四苯基鉛是一種白色固體,難溶於水,可由格氏試劑(苯基溴化鎂)和氯化鉛在乙醚中反應得到:[29]
- C6H5MgBr + 2 PbCl2 → Pb(C6H5)4 + Pb + 4 MgBrCl
四苯基鉛和鹽酸反應,生成氯化三苯基鉛和二氯化二苯基鉛。[30]四苯基鉛和硫在150°C以上發生爆炸:[31]
- Pb(C6H5)4 + 3 S → PbS + (C6H5)2S
有機硫化物(C2H5)3Pb-S-Pb(C2H5)3可以由四乙基鉛和硫反應得到。硒化物(如(CH3)3Pb-Se-R)、碲化物(如(C6H5)3Pb-Te-Pb(C6H5)3)也有報道。[8]
溶解度相圖
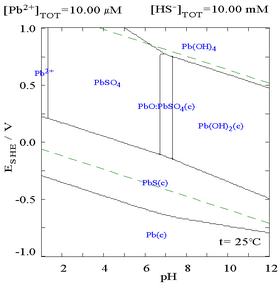
硫酸鉛難溶於水,如圖所示,向含0.1 mol/L的Pb2+溶液中滴加SO42−溶液。溶液的pH為4.5,在此pH之上,Pb2+的濃度不會超過0.1 mol/L,這是因為偏高的pH會促進Pb(OH)2的生成。從圖中可以看出,在SO42−的濃度為0.1 mol/L時,Pb2+的溶解度下降了10000倍。

|
|
| 溶液中溶解的Pb2+與SO42−的關係圖[32] | 含鉛物種在硫酸鹽介質中的電位-pH圖[32] |
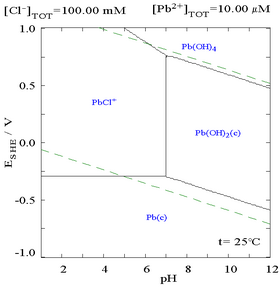
向含有Pb2+的溶液中滴加Cl−,鉛的溶解度變小,當Cl−濃度變得較大時,因形成氯配合物,溶解度再次變大。

|
|
| 溶液中Pb(II)與總氯含量的關係圖[32] | 含鉛物種在氯化物介質中的電位-pH圖[32] |
參考文獻
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.

