أفضل الأسئلة
الجدول الزمني
الدردشة
السياق
بنية جزيئية رباعية السطوح
من ويكيبيديا، الموسوعة الحرة
Remove ads
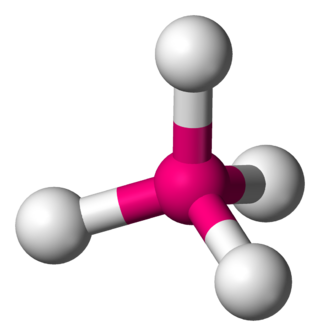
البنية الجزيئية رباعية السطوح هي بنية جزيئية يكون فيها ذرة مركزية يحيط بها أربع متبادلات، تكون واقعة على زوايا رباعي سطوح. تكون الزوايا بين الروابط في هذه البنية cos−1(−1/3) ≈ 109.5°، وذلك عندما تكون المستبدلات الطرفية ذاتها، كما في غاز الميثان CH4.[1][2]
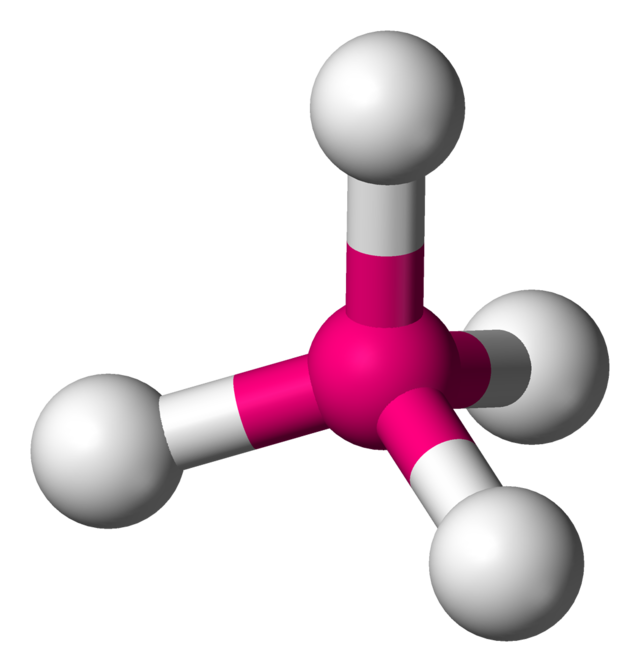
ينتمي رباعي السطوح ذو التناظر التام إلى الزمرة النقطية Td، ولكن في الواقع فإن أغلب الجزيئات لا يكون لها ذلك التناظر التام.
Remove ads
أمثلة
الملخص
السياق
العناصر الأساسية

إن أغلب مركبات عناصر السيليكون Si، والجرمانيوم Ge، والقصدير Sn هي ذات بنية جزيئية رباعية السطوح، باستثناء بعض المركبات العضوية المشبعة. غالباً ما يكون هناك إمكانية للجزيئات ذات البنية رباعية السطوح بأن تمنح فرصة ارتباط مع ربيطات خارجية، كما هو الحال في رباعي أكسيد الزينون (XeO4)، وأنيونات فوق الكلورات (-ClO4) والكبريتات (2-SO4) والفوسفات (3-PO4)، بالإضافة إلى ثلاثي فلوريد الثيازيل SNF3، والذي فيه رابطة ثلاثية بين الكبريت والنتروجين.[3]
يمكن أن يصنف الأمونياك من ضمن الجزيئات ذات البنية رباعية السطوح، وذلك في خال اعتبار الزوج غير الرابط كربيطة كما في اعتبارات نظرية تنافر أزواج إلكترونات غلاف التكافؤ (VSEPR theory). إن الزاوية H-N-H في الأمونياك تبلغ 107°، وهي أقل من 109.4°، ويمكن إرجاع السبب إلى تأثير الزوج الإلكتروني الوحيد.
الفلزات الانتقالية
تشكل الفلزات الانتقالية العديد من المركبات والمعقدات التناسقية التي لها بنية جزيئية رباعية السطوح، وذلك مثل رباعي كلوريد التيتانيوم ورباعي كربونيل النيكل ومرابع (ثلاثي فينيل فوسفين) البالاديوم(0)، بالإضافة إلى العديد من معقّدات الحديد الثنائي (Fe(II والكوبالت الثنائي (Co(II والنيكل الثنائي (Ni(II.
الروابط الهيدروجينية للماء
يوجد الماء السائل في بنيته الجزيئية على شكل رباعيات سطوح، بحيث تكون ذرة الأكسجين في المركز وتكون مرتبطة تساهمياً مع ذرّتي هيدروجين، ومرتبطة مع ذرتي هيدروجين إضافيتين بواسطة الروابط الهيدروجينية. لا يكون رباعي السطوح في هذ الحالة متناظراً لتفاوت أطوال الروابط.[4]
Remove ads
الاستثناءات والتشوّهات
يمكن للمركبات التي لها بنية جزيئية رباعية السطوح أن تحدث لها تشوّهات أو تغيّرات في التناظر، وذلك فيما يسمى انقلاب. في المركبات العضوية تلاحظ ظاهرة انقلاب فالدن، وهي تحدث في المركبات بالنسبة لذرة الكربون، بالإضافة إلى حدوث ظاهرة الانقلاب النتروجيني في الأمونياك NH3 بالنسبة لذرة النتروجين.
يمكن أن يحدث انقلاب في بنية الجزيء رباعية السطوح عند وجود إعاقات فراغية، ويدعة حينها الكربون باسم الكربون المنقلب، وتكون البنية أقرب للهرمية.[5]
من الأمثلة على وجود كربون منقلب في جزيء هي مركبات البروبلانات propellanes مثل 1.1.1-بروبلان، أو بادلان paddlanes،[6] أو بيراميدان pyramidanes.[7][8]
في الحالات القصوى، يمكن في النهابة أن تحدث عملية تشوّه لرباعي السطوح بحيث تحصل تسوية Planarization، حيث أن هذه الظاهرة تلاحظ في فئة من المركبات تدعى باسم فينيسترانات Fenestrane.
Remove ads
المراجع
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads