أفضل الأسئلة
الجدول الزمني
الدردشة
السياق
فانكوميسين
مضاد حيوي ببتيدي سكري يستعمل لعلاج عداوى بكتيرية محددة من ويكيبيديا، الموسوعة الحرة
Remove ads
فانكوميسين (الاسم العلمي: Vancomycin) هو مضادٌ حيويٌ ببتيديٌ سكري يستعمل لعلاج عداوًى بكتيريةٍ محددة.[5] يُعطى وريديًا لعلاج الحالات المُعقدة من عداوى الجلد، والإنتان، والتهاب الشغاف، وعداوى المفاصل والعظام، والتهاب السحايا الناتج عن المكورات العنقودية الذهبية المقاومة للميثيسيلين.[6] يُمكن قياس مستويات الفانكوميسين في الدم لتحديد الجرعة الصحيحة.[7] يُعطى الفانكوميسين فمويًا لعلاج عداوى المطثِّيَّة العسيرة،[5][8][9] مع العلم بأنَّ امتصاصه يكون ضعيفًا عن إعطائه فمويًا.[5]
قد يُسبب الفانكوميسين عددًا من الآثار الجانبيَّة، وتتضمن حدوث ألمٍ في منطقة الحقن مع ردود فعلٍ تحسسيَّة.[5] كما قد يُسبب أحيانًا فقدان السمع أو انخفاض ضغط الدم أو كبت نِقْي العظم.[5] لم تتضح سلامة هذا الدواء أثناء الحمل، ولكن لم يُعثر على أي دليلٍ على ضرره،[5][10] ويُرجح بأنَّ استعماله آمنٌ أثناء الرضاعة الطبيعية.[11] يُعد الفانكوميسين نوعًا من المضادات الحيويَّة الببتيديَّة السكريَّة، حيث يعمل على منع بناء الجدار الخلوي.[5]
اعتُمد الفانكوميسين لاستعماله طبيًا في الولايات المتحدة عام 1958.[12] كما أُدرج في قائمة الأدوية الأساسية النموذجية لمنظمة الصحة العالمية،[13] وتصنفه منظمة الصحة العالمية بأنه هامٌ للغاية في الطب البشري.[14] يُصنّع الفانكوميسين بواسطة بكتيريا التربة شبيهة عديمة الميكولات الشرقية (الاسم العلمي: Amycolatopsis orientalis).[5]
Remove ads
التسمية
الملخص
السياق
اكتُشف هذا الدواء للمرة الأولى عام 1953 بواسطة إدموند كورنفيلد والذي كان يعمل آنذاك لدى إيلي ليلي وشركاءه،[15] وأُطلق عليه بدايةً اسم «Compound 05865» والتي تعني «المركب 05865»،[12] ثم تغيرت فيما بعد إلى تسميَّة «Vancomycin». اشتق الاسم من كلمتين «Vanco-mycin»، وهي بادئة «Vanco-» من «vanquish» وتعني «التغلب على شيءٍ ما»،[ar 1] ولاحقة «-mycin» والتي تضاف لأسماء المضادات الحيويَّة التي تنتجها سلالات المتسلسلة (الاسم العلمي: Streptomyces).[16] يُشير موقع ميريام وبستر بأنَّ أصل بادئة «Vanco-» غير معروفٍ، وأنَّ الادعاءات بأنها مشتقةٌ من «vanquish» هي ادعاءاتٌ حديثةٌ معاصرةٌ غيرُ مدعومةٍ بمصادر أوليَّة.[17]
يؤكد مصدرٌ آخر على أنَّ بادئة «Vanco-» مشتقةٌ من «vanquish»، ويختلف بأنَّ لاحقة «-mycin» مشتقةٌ من «mykes» الإغريقية والتي تعني الفطر، معللًا ذلك بأنَّ الفانكوميسين يُصنّع بواسطة بكتيريا التربة شبيهة عديمة الميكولات الشرقية،[5] والتي تنتمي في نقطةٍ ما إلى رتبة الشعيّات (أو الفطريات المشعة)، ويُحتمل أنها سمية كذلك لخصائصها الشبيهة بالفطريات. كما يذكر بأنَّ الفانكوميسين كان بمظهر «المحارب الشّرس» الوحيد القادر على «القضاء/هزيمة/التغلب» (vanquish) على المكورات العنقودية الذهبية المقاومة للميثيسيلين (اختصارًا MRSA)، ولكن تبين مع الوقت بأنَّ هذا الأمر لم يعد صحيحًا تمامًا، ولا يقتصر الأمر على الفانكوميسين.[18]
يُشار بأنَّ هذا الداء سوَّق تجاريًا للمرة الأولى بواسطة إيلي ليلي وشركاءه عام 1958 بتركيبة «هيدروكلوريد الفانكوميسين»[19] وعرف تجاريًا باسم «فانكوسين».[ar 2]
المؤلفات العربيَّة
لعلَّ أول ذكرٍ لهذا المضاد الحيوي في المؤلفات العربية كان مقالةً عنوانها «ماذا في الطب من الجديد؟» نشرت في «مجلة الهلال» في 1 أبريل 1957، والتي ذكرت قسمًا عنوانه «عقاقير لأمراض الأمعاء» تسرد فيه الآتي «قرر الأطباء الدكاترة جوزيف جيراسي، فوردابس هيلمان، دونالد بكولز، وليام ولمان أنه قد ثبت لتجارب أنَّ فنكومايسين Vancomycin هو عقار جديد قوي مضاد للحيويات، علاج نافع ضد الأمراض المعوية وهو مستخرج من نفس صنف البكتيريا التي تنتج ستربتومايسين والتراميسين. ويعطى هذا العقار إما بتناوله بالفم وإما بالحقن في الوريد، فيسري بسرعةٍ إلى الرئة والقلب والفجوات المعوية فيقضي على ما يوجد من الجراثيم العنقودية Micrococcal. والميزة العظيمة لهذا العقار أن البكتيريا لا تستطيع أن تكون لنفسها مناعةً ضده بالسرعة التي تكونها بها في حالة العقاقير الأخرى المضادة للحيويات. وهو كذلك لا يحدث رد فعل سام في أغلب الناس، وهو لا يتعارض مع العقاقير الأخرى التي يجوز أن تعطى معه».[ar 3]
ورد ذكره أيضًا في «دستور الأدوية المصري» الصادر عام 1972 عن الهيئة العامة لشؤون المطابع الأميرية والذي أشار له تحت اسم «فنكوميسين - إيدروكلوريد (ڤنكوميسين هيدروكلوريدوم)» وعرفه بأنَّ «إيدروكلوريد الڤنكوميسين هو مضاد حيوي ينتج غالبا بنمو الفطر «استربتوميسيس أورينتالس» أو بأي طريقة أخرى».[ar 4] أيضًا نشر بحثٌ عنوانه «مضادات حيوية» في مجلة «رسالة العلم» الصادرة في يونيو 1973 نشره الطبيب المصري محمد صادق صبور والذي كان يعمل آنذاك في كلية طب جامعة عين شمس، وذكر بأنَّ «فانكومايسين: تم الحصول عليه من كائن حي من عينات من التربة من أندونيسيا ومن الهند عام 1956 وهو عقار قاتل لجميع المكورات السبحية والعنقودية والرئوية ومكورات السيلان».[ar 5]
يُعربه الجزء الرابع من «معجم مصطلحات العلم والتكنولوجيا» الصادر عام 1988 عن معهد الإنماء العربي إلى «فانكوميسين»، كما يُعرفه بأنه «مادة حيوية مضادّة مُعقَّدة ناتجة من النوع Streptomyces orientalis. وهي مفيدة لمعالجة الإصابات الحادّة التي تسببها المُكورات العنقودية».[ar 6] كما يُعربه «معجم الكيمياء والصيدلة» الصادر عام 1994 عن مجمع اللغة العربية بالقاهرة مصطلح «Vancomycin hydrochloride» إلى «هدروكلوريد فنكومايسين»، ويُعرفه بأنَّه «مضاد حيوي ينتجه فطر استربتومايسس أوريانتالس وهو مسحوق بني يذوب في الماء».[ar 7] أما «قاموس حتّي الطبي الجديد» الصادر عام 2011 عن مكتبة لبنان ناشرون فيعربه إلى «فَنْكُومَيْسين»، ويكمل بأنه «مضادٌ حيوي للعُنقوديات المنيعة على المضادات الأخرى».[ar 8]
يُلاحظ بأنَّ المؤلفات الطبية العربيَّة أجمعت تقريبًا في تعريب مصطلح «Vancomycin» إلى «فانكوميسين»،[ar 9] وبدرجةٍ أقل «فانكومايسين»[ar 10] و«فَنْكوميسين»[ar 11] و«فنكومايسين».[ar 7]
Remove ads
الاستعمالات الطبية
الملخص
السياق
يستعمل الفانكوميسين لعلاج العداوى الخطيرة والمهددة للحياة التي تسببها بكتيريا إيجابية الغرام من النوعين الهوائي واللاهوائي[20] والتي لا تستجيب لمضاداتٍ حيويةٍ أخرى.[21][22][23]
أدى تزايد ظهور المكوَّرات المعويَّة المقاومة للفانكوميسين (VRE) إلى وضع إرشاداتٍ لاستعمال الفانكوميسين بواسطة اللجنة الاستشارية لممارسات مكافحة عدوى المستشفيات التابعة لمراكز السيطرة على الأمراض والوقاية منها. تقتصر هذه الإرشادات على استخدام الفانكوميسين في الحالات التالية:[24][25]
- علاج العداوى الخطيرة التي تسببها كائناتٌ حيَّة مستعدّةٌ لمقاومة البنسلينات، مثل المكورات العنقودية الذهبية المقاومة للميثيسيلين (MRSA) والعنقوديَّة البَشْرَويَّة (MRSE) المقاومة لأدويةٍ متعددة.
- علاج العداوى في الأفراد الذين يعانون من حساسيةٍ شديدةٍ للبنسلين.
- علاج التهاب القولون الغشائي الكاذب الذي تُسببه المطثِّيَّة العسيرة، وخاصةً في حالات الانتكاس أو عدم استجابة العدوى للعلاج بالمترونيدازول (لذلك، يُعطى الفانكوميسين عن طريق الفم بدلًا من الوريد).
- علاج العداوى التي تسببها كائناتٌ دقيقةٌ إيجابية الغرام في المرضى الذين يعانون من حساسيةٍ شديدةٍ تُجاه مضادات المكروبات البيتا لاكتاميَّة.[25]
- الوقاية بالمضادات الحيوية لالتهاب الشغاف بعد بعض الإجراءات الطبيَّة لدى الأشخاص الذين يعانون من فرط التحسس للبنسلين والمعرضين لخطر أكبر لحدوث العدوى.[25]
- الوقاية قبل الإجراءات الجراحيَّة الرئيسية التي تتضمن بِدْلاَتٍ (أعضاء بديلة) في المؤسسات التي ترتفع فيها معدلات الإصابة بالمكورات العنقودية الذهبية المقاومة للميثيسيلين.[25]
- في بداية العلاج مضادًا حيويًّا تجريبيًا لاحتمالية الإصابة بالمكورات العنقودية الذهبية المقاومة للميثيسيلين، ريثما يُحدد الكائن المسبب للعدوى عبر الزراعة.
- إيقاف تفاقم التهاب الأقنية الصفراويَّة المُصلّب الأوَّلي ومنع الأعراض، مع العلم بأنَّ الفانكوميسين لا يشفي المريض، ونجاحه محدود.
- علاج التهاب باطن المقلة عبر حقنه داخل الجسم الزُّجاجي لتغطية البكتيريا إيجابية الغرام.[26] كما استُخدم للوقاية من هذه الحالة، ولكن لا يُنصح به بسبب خطر الآثار الجانبية.[27]
الطيف
يُعد الفانكوميسين دواءًا يُلجأ إليه ملاذًا أخيرًا لعلاج الإنتان وعداوى الجهاز التنفسي السُّفلي والجلد والعظام التي تسببها بكتيريا إيجابية الغرام. تُظهر بيانات حساسيَّة التركيز التثبيطي الأدنى لعددٍ من البكتيريا الهامة طبيًا:[28]
- العنقوديَّة الذَّهبيَّة (الاسم العلمي: Staphylococcus aureus): 0.25 إلى 4.0 ميكروغرام/مليلتر
- العنقوديَّة الذَّهبيَّة (المقاومة للميثيسيلين): 1 إلى 138 ميكروغرام/مليلتر
- العنقوديَّة البَشْرَويَّة (الاسم العلمي: Staphylococcus epidermidis): ≤0.12 إلى 6.25 ميكروغرام/مليلتر
المقاومة
المقاومة الطبيعية
بعضُ أنواع البكتيريا إيجابية الغرام، مثل النُّسْتُق (الاسم العلمي: Leuconostoc) والمُمَلَّسَة (الاسم العلمي: Pediococcus)، تمتلك مقاومةً طبيعيةً للفانكوميسين، ولكنَّ هذا الأنواع نادرًا ما تُسبب أمراضًا في البشر.[29] أيضًا، مُعظم أنواع المُلبِّنة (الاسم العلمي: Lactobacillus) تمتلك مقاومةً طبيعيةً للفانكوميسين،[29] باستثناء المُلبِّنة المُحَمِّضَة (الاسم العلمي: Lactobacillus acidophilus) والمُلبِّنة الدلبروكية (الاسم العلمي: Lactobacillus delbrueckii).[30] كما توجد أنواعٌ أخرى من البكتيريا إيجابية الغرام المقاومة طبيعيًا للفانكوميسين، وتشمل الشَّعْريَّة الحُمْرانيَّة المُخاتلة[الإنجليزية] (الاسم العلمي: Erysipelothrix rhusiopathiae)، والفايسيلا المُلتَبسة[الإنجليزية] (الاسم العلمي: Weissella confusa)، والمطثِّيَّة عديمة الضرر (الاسم العلمي: Clostridium innocuum).[31][32][33]
معظم أنواع البكتيريا سلبية الغرام مقاومةٌ طبيعيًا للفانكوميسين؛ لأنَّ أغشيتها الخارجية غير منفذةٍ لجزيئات الببتيد السكري الكبيرة[34] (باستثناء بعض أنواع النيسريَّة غير البُنِّيَّة).[35]
المقاومة المكتسبة
يُمثل تطور مقاومة المكروبات للفانكوميسين مشكلةً متنامية، لا سيمّا في مرافق الرعاية الصحية مثل المستشفيات. وعلى الرغم من وجود بدائل أحدث للفانكوميسين، مثل اللينيزوليد (2000) والدابتوميسين (2003)، إلا أنَّ الاستخدام الواسع للفانكوميسين يجعل مقاومته مصدرَ قلقٍ بالغ، خاصةً إذا لم تُكتشف مقاومة العدوى بسرعةٍ واستمر المريض في تلقي علاجٍ غير فعال. ظهرت المكوَّرات المعويَّة المقاومة للفانكوميسين (VRE) عام 1986.[36] تطورت مقاومة الفانكوميسين في الكائنات الممرضة الأكثر شيوعًا خلال عقد 1990 وعقد 2000، وتشمل المكورات العنقودية الذهبية المتوسطة للفانكوميسين (VISA) والمكورات العنقودية الذهبية المقاومة للفانكوميسين (VRSA).[37][38] تُشير بعض الدراسات، بأنَّ الاستخدام الزراعي للأفوبارسين[الإنجليزية]، وهو مضادٌ حيويٌ ببتيديٌ سكري مشابه للفانكوميسين، رُبما ساهم في تطور الكائنات المقاومة للفانكوميسين.[39][40][41][42]
تتضمن إحدى آليات مقاومة الفانكوميسين تغيير بقايا الأحماض الأمينية الطرفيَّة لوُحيدات ببتيد NAM/NAG، في الظروف الاعتياديَّة، وهي D-ألانيل-D-ألانين، التي يرتبط بها الفانكوميسين. يؤدي تباين D-ألانيل-D-لاكتات إلى فقدان تفاعل رابطة هيدروجينية واحد (4، مقابل 5 في D-ألانيل-D-ألانين) محتمل بين الفانكوميسين والببتيد. يؤدي فقدان نقطة تفاعل واحدة فقط إلى انخفاضٍ في الألفة بمقدار ألف ضعف. يؤدي تباين D-ألانيل-D-سيرين إلى فقدان ستة أضعاف في الألفة بين الفانكوميسين والببتيد، ويرجع ذلك على الأرجح إلى عائق فراغي.[43]
يبدو أنَّ هذا التعديل في المكورات المعوية، ناتجٌ عن التعبير عن إنزيمٍ يُغير البقايا الطرفيَّة. وقد وُصفت حتى الآن ثلاثة متغيراتٍ مقاومةٍ رئيسيةٍ بين سلالات المكورات المعوية البرازية (الاسم العلمي: Enterococcus faecium) ومكورات معوية البراز (الاسم العلمي: Enterococcus faecalis):
- VanA - مقاومة المكورات المعوية للفانكوميسين والتيكوبلانين، وهي قابلةٌ للتحريض عند التعرض لهاتين المادتين.
- VanB - مقاومة المكورات المعوية منخفضة المستوى، وهي قابلةٌ للتحريض بواسطة الفانكوميسين، ولكن قد تبقى السلالات حساسةٍ للتيكوبلانين.
- VanC - مقاومة المكورات المعوية للفانكوميسين فقط، وهي الأقل أهمية سريريًا، وتُعد مقاومة بنيويَّة.
اختُبر أحد متغيرات الفانكوميسين الذي يرتبط مع دي-حمض اللاكتيك المقاوم في جدران الخلايا البكتيرية المقاومة للفانكوميسين، ويرتبط أيضًا بشكلٍ جيد بالهدف الأصلي (البكتيريا الحساسة للفانكوميسين).[44][45]
الفانكوميسين "المسترجع"
استطاع فريقٌ من مستشفى هايدلبرغ الجامعي في ألمانيا عام 2020 استعادة فعالية الفانكوميسين المضادة للبكتيريا، وذلك عن طريق تحويّر الجزيء باستخدامقليل الببتيد الكاتيوني. يتكون قليل الببتيد من ست وحداتٍ من الأرجنين في الموضع VN. إذا قُورن مع الفانكوميسين غير المُعدّل، فإنَّ النشاط المضاد للبكتيريا المقاومة للفانكوميسين قد تعزز بعاملٍ قدره 1000.[46][47] لا يزال هذا الدواء في مرحلة التجربة غير السريريَّة.
Remove ads
الآثار الجانبية
الملخص
السياق
الإعطاء الفموي
قد يؤدي الإعطاء الفموي للفانكوميسين لعلاج العداوى المعوية إلى بعض الآثار الجانبية،[48] ومنها آثارٌ على الجهاز الهضمي وتشمل ألم البطن والغثيان.[48] إضافةً إلى خلل الذوق، الذي يرتبط مع إعطاء الفانكوميسين في محلولٍ فموي وليس في كبسولات.[48]
الإعطاء الوريدي
قد يُراقب مستوى الفانكوميسين في الدم لتقليل الآثار الجانبية،[49] وإن أثيرت تساؤلات حول أهمية تلك المراقبة.[50] عادة ما تُراقب مستويات القمة والقاع، ويُستخدم أحيانًا لأغراض البحث قياس المساحة تحت منحنى التركيز.[51] أفضل طريقة لقياس التأثير السمي هو قياس مستويات القاع[الإنجليزية].[51] يشيع استخدام المقايسات المناعيَّة.[49]
تشمل التفاعلات الدوائية الضائرة الشائعة (≥1% من المرضى) والمرتبطة بإعطاء الفانكوميسين وريديًا الآتي:
- ألم واحمرار وتورم في موضع الحقن.[52]
- تفاعل الاحمرار للفانكوميسين، والمعروف سابقًا بمتلازمة الرجل الأحمر.[48]
- التهاب الوريد الخثاري، ويشيع عند إعطاء الفانكوميسين عبر قثطار وريدي طرفي ويقل عند استخدام قثطار وريدي مركزي على أن الأخيرة عامل خطرٍ لحدوث خثار وريدي عميق في الأطراف العلوية.[53]
سببت الإصدارات غير النقية المبكرة من الفانكوميسين أضرارًا على الكُلى (سمية الكلية) والسمع (سمية الأذن)، وبرزت هذه الآثار في التجارب السريرية في منتصف الخمسينيات،[12][19] ولكن أظهرت التجارب التي استخدمت صورًا أنقى من الفانكوميسين أن سمية الكلية أثرٌ جانبيٌّ نادرٌ (0.1% إلى 1% من المرضى)، ولكنه يزداد مع استخدام الأمينوغليكوزيدات.[54]
تشمل الآثار الجانبية النادرة (<0.1% من المرضى) والمرتبطة بإعطاء الفانكوميسين وريديًا صدمة الحساسية وتقشر الأنسجة المتموتة البشروية التسممي والحمامى عديدة الأشكال والعدوى الإضافية وقلة الصفيحات وقلة الخلايا المتعادلة وقلة الكريات البيض والطنين والدوخة وربما سمية الأذن وتفاعلات دوائية مترافقة مع فرط الحمضات والأعراض الجهازية.[55]
يمكن أن يُحفز الفانكوميسين تكوين أجسام مضادة تفاعلية مع الصفائح الدموية، مما يؤدي إلى نقص حاد في الصفائح الدموية ونزيف متورد مع الحبرات ورضات وفرفرية رطبة.[56]
كان يُنظر إلى الفانكوميسين سابقًا على أنه دواءٌ سامٌ للكلية والأذن اعتمادًا على عدة تقارير طبية منذ موافقة إدارة الغذاء والدواء الأمريكية عليه عام 1958، وأُعيد تقييم مخاطر سميته في سبعينيات القرن العشرين مع تزايد استخدامه لكافحة المكورات العنقودية الذهبية المقاومة للميثيسيلين، وقد انخفض خطر السمية مع إزالة الشوائب من التركيبات غير النقية المبكرة من الدواء[12] إضافةً إلى إدخال مراقبة الأدوية العلاجية.
سمية الكلية
لا يزال الجدل قائمًا حول تسبب الفانكوميسين في حدوث سمية الكلية.[57] سُجل في ثمانينيات القرن العشرين حدوث سميَّة الكلية بين قرابة 5% من المرضى الذين تعاطوا عقارات يفوق نقاء الفانكوميسين فيها 90% حيث ارتفع مستوى الكرياتينين في بلازما الدم عن 0.5 ملغ/ديسيلتر،[57] وقد أوصت مع ذلك إرشادات الجرعات من الثمانينيات حتى عام 2008 بمستويات قاع للفانكوميسين تتراوح بين 5 و15 مكغ/مل،[58] وقد أُوصِيَ بعد ذلك بزيادة الجرعات لعلاج العدوى الخطيرة بمستويات قاع تتراوح بين 15 و20 ميكروغرام/مل خوفًا من فشل العلاج ما أدى إلى ارتفاع معدلات إصابة الكلى الحادة المرتبطة بالفانكوميسين.[59]
يزداد خطر إصابات الكلى الحادة مع تعاطي مواد أخرى معروفة بسميتها على الكلى مثل الأمينوغليكوزيدات، كما أن العدوى التي يعالجها الفانكوميسين قد تسبب أيضًا إصاباتٍ حادة للكلى حيث أن تعفن الدم يعد السبب الأكثر شيوعًا لإصابات الكلى الحادة بين المرضى المصابين بأمراض خطرة. يجدر الإشارة إلى أن الدراسات العلمية التي تُجرى على البشر تقوم أساسًا على دراسات الترابط، وأسباب إصابات الكلى الحادة عديدة العوامل.[60][61][62][63]
أظهرت الدراسات على الحيوانات وجود ارتباط بين الجرعات العالية ومدد التعرض الطويلة للفانكوميسين وبين ازدياد الضرر النسيجي وارتفاع مؤشرات إصابة الكلى عند تحليل البول.[64] يكون الضرر أوضح في الأنيبيبات الكلوية القريبة وهو ما تدعمه الواسمات الحيوية البولية مثل جزيء إصابة الكلى-1 (KIM-1) والكلسترين[الإنجليزية] والأوستيوبونتين.[65] يُستخدم بروتين ربط عامل النمو شبيه الإنسولين 7[الإنجليزية] في فحوصات الكلى بين البشر للكشف عن إصابات الكلى الحادة.
آليات سمية الكلية من الفانكوميسين عديدة العوامل فمنها التهاب الكلية الخلالي وإصابة الأنيبيبات نتيجة الإجهاد التأكسدي وتكوين الأسطوانات البولية.[59]
تُفعَّل مراقبة الأدوية العلاجية أثناء إعطاء الفانكوميسين لتقليل خطر سمية الكلية المرتبط بالإفراط في الدواء، ويشيع استخدام المقايسات المناعيَّة لقياس مستوى الفانكوميسين في الدم.[49]
وُجد ارتفاعٌ في معدلات إصابة الكلى الحادة بين الأطفال عند تناولهم للفانكوميسين مع بيبراسيلين/تازوباكتام مقارنة مع أنظمة المضادات الحيوية الأخرى.[66]
سمية الأذن
تجمع الآراء على ندرة الحالات التي يرتبط فيها الفانكوميسين بسمية الأذن ارتباطًا واضحًا،[67][68] وقد واجهت محاولات تحديد معدلات سمية الأذن الناتجة عن الفانكوميسين صعوبة كبيرة لنقص البيانات الدقيقة. العلاقة بين مستويات الفانكوميسين في الدم وحدوث سمية الأذن غير مؤكدة، فقد سُجّلت حالات سمية الأذن بين مرضى تجاوز مستوى الفانكوميسين في دمهم 80 مكغ/مل،[69] وسٌجلت أيضًا حالات السمية بين مرضى لديهم مستويات علاجية طبيعية، ولهذا الأمر فلا يُعرف حتى الآن إذا كانت مراقبة الأدوية العلاجية للفانكوميسين قادرةً على منع حدوث سمية الأذن عند الحفاظ على المستويات العلاجية للفانكوميسين أم لا،[69] ولكن يمكن استخدام مراقبة الأدوية العلاجية مع الفانكوميسين لتقليل خطر سمية الأذن المرتبط بالإعطاء المفرط للدواء.[49]
التفاعل مع الذيفانات الكلوية الأخرى
من الأمور التي يكثر حولها الخلاف أيضًا هو إمكانية أن يزيد الفانكوميسين من سمية الذيفانات الكلوية وإلى أي مدى يمكنه فعل ذلك، ولقد أظهرت الدراسات السريرية نتائج متباينة في هذا الأمر. أظهرت النماذج الحيوانية إلى ازدياد أثر سمية الكلية على الأرجح مع إعطاء مواد أخرى معروفة بسميتها على الكلى مثل الأمينوغليكوزيدات. لم يُثبت وجود علاقة مباشرة بين مستوى الفانكوميسين ودرجة سمية الكلية حتى الآن.[بحاجة لمصدر]
تفاعل الاحمرار للفانكوميسين (متلازمة الرجل الأحمر)
يُنصح بإعطاء الفانكوميسين ببطء في محلولٍ مخفف في 60 دقيقةٍ على الأقل (المعدل الأقصى 10 مل/دقيقة في الجرعات التي تتجاوز 500 مل)،[24] وذلك لارتفاع معدلات حدوث الألم والتهاب الوريد الخثاري، وأيضًا لتفادي متلازمة إفراز السيتوكين التي تسبب تفاعل الاحمرار للفانكوميسين. يُعرف هذا التفاعل أيضًا باسم متلازمة الرجل الأحمر، ويظهر عادةً بعد مرور من 4 إلى 10 دقائق من بدء إفراز السيتوكين أو بعد انتهائه بفترةٍ قصيرة، ويتسم بالتورد و/أو الحُمامى التي تصيب الوجه والرقبة وأعلى الجذع، وهذا بسبب خروج الهستامين من الخلايا البدينة. يحدث هذا التفاعل نتيجة تفاعل الفانكوميسين مع مستقبِل MRGPRX2[الإنجليزية].[70] قد يحدث نادرًا انخفاضٌ في ضغط الدم أو وذمةٌ وعائيَّة. قد تُعالج الأعراض أو يوقى منها بمضادات الهستامين بما فيها الديفينهيدرامين، كما أن إعطاء الفانكوميسين ببطءٍ يقلل هذا التفاعل.[71][72]
Remove ads
اعتبارات الجرعة
الجرعة الوريدية الموصى بها للبالغين هي 500 ملغ كل 6 ساعات أو 1000 ملغ كل 12 ساعة، مع إمكانية تعديلها للوصول إلى نطاقٍ علاجيٍ مناسب حسب الحاجة. أما الجرعة الفموية الموصى بها التهاب القولون الغشائي الكاذب الناتج عن المضادات الحيوية هي 125 إلى 500 ملغ كل 6 ساعات لمدةٍ تتراوح بين 7 إلى 10 أيام.[73]
يتضمن تحسين الجرعة وتحقيق الهدف العلاجي للفانكوميسين في الأطفال تعديل الجرعة لتحقيق أقصى فعالية مع تقليل مخاطر الآثار الجانبية، وخاصةً تلف الكلى الحاد. يُمكن تحسين الجرعة من خلال مراقبة الدواء العلاجي (TDM)، والتي تسمح بقياس مستويات الفانكوميسين في الدم. يُوصى باستخدام هذه الآلية لتحديد الجرعات بناءً على المساحة تحت المنحنى (AUC)، ويفضل استخدام التنبؤ البايزي، لضمان الحفاظ على نسبة «المساحة تحت المنحنى الصفريَّة (AUC0)-24 ساعة/التركيز التثبيطي الأدنى» فوق عتبةٍ معينة (400-600) والتي ترتبط بالفعالية المثلى.[74]
Remove ads
طرق الإعطاء
سُمح بالإعطاء الفموي والوريدي للفانكوميسين في الولايات المتحدة من قبل إدارة الغذاء والدواء الأمريكية.[48]
وريديًا
يجب إعطاء الفانكوميسين وريديًا للعلاج الجهازي؛ وذلك نظرًا لصعوبة امتصاصه من الأمعاء. وهو جزيء كبيرٌ أليفٌ للماء، وينتشر بشكلٍ ضعيف عبر الغشاء المخاطي المعدي المعوي. يُعطى عادةً مرتين يوميًا، وذلك نظرًا لقصر عمره النصفي.[75]
فمويًا
الاستعمال الوحيد المُعتمد للعلاج بالفانكوميسين فمويًا هو علاج التهاب القولون الغشائي الكاذب، حيث يُعطى فمويًا للوصول إلى موقع العدوى في القولون. بعد الإعطاء الفموي، يبلغ تركيز الفانكوميسين في البراز حوالي 500 مكغ/مل[76] (السلالات الحساسة من المطثِّيَّة العسيرة لها متوسط تركيز تثبيطي ≤2 مكغ/مل[77]).
بالاستنشاق
يمكن أيضًا استخدام الفانكوميسين بالاستنشاق دون تصريحٍ طبي،[78] حيث يستعمل عبر الرَذَّاذة، لعلاج التهاباتٍ مختلفة في الجهاز التنفسي العلوي والسفلي.[79][80][81][82][83]
بالمستقيم
يعد الإعطاء المستقيمي للفانكوميسين استخدامًا دون تصريحٍ لعلاج عدوى المطثِّيَّة العسيرة.[48]
Remove ads
مراقبة الجرعة العلاجية
الملخص
السياق
تُعدّ مراقبة مستوى الفانكوميسين في البلازما ضروريةً نظرًا لتوزيعه ثنائي الأسّ، وأُلفته المتوسطة للماء، واحتمالية سميته للأذن والكلى، خاصةً في الأفراد الذين يعانون من ضعفٍ في وظائف الكلى و/أو زيادةً في قابلية الإصابة بعدوًى بكتيريَّة. يرتبط نشاط الفانكوميسين بالوقت، أي أن النشاط المضاد للمِكروبات يعتمد على مدة تجاوز تركيز الدواء في المصل للتركيز التثبيطي الأدنى للكائن المستهدف. وبالتالي، لم يُثبت ارتباط مستويات الذروة في المصل بالفعالية أو السميَّة، بل إن مراقبة التركيز غير ضروريةٍ في معظم الحالات. تشمل الحالات التي تستدعي مراقبة الدواء العلاجي المرضى الذين يتلقون علاجًا مصاحبًا بالأمينوغليكوزيد، والمرضى الذين يعانون (ربما) من تغيراتٍ في معايير الحركية الدوائيَّة، والمرضى الذين يخضعون لغسيل الكلى، والمرضى الذين يتلقون علاجًا بجرعاتٍ عالية أو لفتراتٍ طويلة، والمرضى الذين يعانون من ضعفٍ في وظائف الكلى. في مثل هذه الحالات، تُقاس التركيزات الدنيا (تركيزات القاع).[24][50][84][85]
كما تستخدم مراقبة الدواء العلاجي لتحسين جرعة الفانكوميسين في علاج الأطفال.[74]
تغيرت النطاقات المستهدفة لتركيزات الفانكوميسين في المصل على مر السنين. اقترح الباحثون الأوائل مستويات ذروةٍ تتراوح بين 30-40 ملغ/لتر ومستويات قاعٍ[الإنجليزية] تتراوح بين 5-10 ملغ/لتر،[86] إلا أن التوصيات الحالية تنص على عدم الحاجة إلى قياس مستويات الذروة، وأنَّ مستويات القاع التي تتراوح بين 10-15 ملغ/لتر أو 15-20 ملغ/لتر، حسب طبيعة العدوى واحتياجات المريض الخاصة، قد تكون مناسبة.[87][88] يُحسّن قياس تركيزات الفانكوميسين لحساب الجرعات العلاج لدى المرضى الذين يعانون من تصفيةٍ كلويةٍ مَزيْدة[الإنجليزية].[89]
Remove ads
الكيمياء
الفانكوميسين هو ببتيد لاريبوزومي ثلاثي الحلقات متفرّع ومغلكز؛ وهو ينتج من أنواع من الشعيّة الفطرية تسمى «Amycolatopsis orientalis».[90]
يبدي فانكوميسين ظاهرة التصاوغ اللادوراني، إذ تحوي بنية الجزيء على بنى فراغية محددة ومتعددة تؤدي إلى إعاقة عملية دوران بعض الروابط الكيميائية.[91]
الاصطناع الحيوي
الملخص
السياق
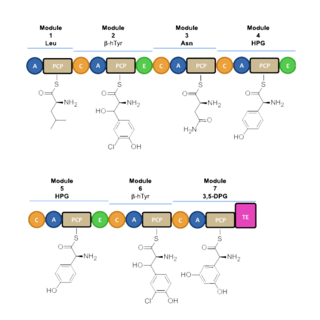
يحدث الاصطناع الحيوي للفانكوميسين بشكل رئيسي عبر ثلاثة إنزيمات مخلّقة ببتيدية لاريبوزومية (NRPSs) وهي VpsA و VpsB و VpsC.[92] تحدد تلك الإنزيمات تسلسل الأحماض الأمينية أثناء عملية تجميع البروتين عبر الوحدات السبع. يسبق ذلك عملية اصطناع حيوي للببتيدات اللاريبوزومية؛ إذ يحوّر التيروسين إلى هيدروكسي تيروسين (β-HT) و4-هيدروكسي فينيل غلايسين (4-Hpg)، في حين يستحصل على 5،3-ثنائي هيدروكسي فينيل غلايسين (5,3-DPG) من الأسيتات الموافقة.[93] يساهم عدد من الإنزيمات الببتيدية اللاريبوزومية في عملية اصطناع هيدروكسي تيروسين (β-HT) من التيروسين، إذ يفعّل التيروسين ويحمّل على VpsD، ثم يهدرل من OxyD، ثم يحرر عبر ثيوإستراز Vhp.[94]

تتم عملية اصطناع الببتيد اللاريبوزومي عبر وحدات مميزة قادرة على تحميل البروتين والتوسع في تركيبه من خلال الارتباط مع حمض أميني مميز لكل وحدة (طالع الشكل 1)، حيث تتشكل رابطة أميدية عند مواقع الارتباط في النطاقات المفعّلة.[95] تتكون كل وحدة نمطياً من ثلاثة نطاقات بروتينية، وهي نطاق (A) من أدينوسين أحادي الفوسفات، ونطاق (PCP) البروتين الحامل للببتيديل، ونطاق (C) وهو نطاق تكاثف. من النطاقات الأخرى الداخلة في الاصطناع الحيوي للفانكوميسين كل من نطاق (E) وهو نطاق التصاوغ الصنوي والذي يساهم في تصاوغ الأحماض الأمينية من شكل فراغي لآخر؛ ونطاق (TE) وهو نطاق ثيوإستراز. يتفعّل الحمض الأميني المحدد في النطاق A من التحويل إلى معقد إنزيمي من أمينو أسيل أدينيلات المرتبط إلى عامل مرافق من 4'-فوسفوبانتيثين عبر تفاعل ثيوأسترة.[96][97] ينقل المعقد بعدئذ إلى نطاق PCP عبر التخلص من وحدة أدينوسين أحادي الفوسفات. يستخدم نطاق PCP مجموعة 4'-فوسفوبانتيثين من أجل تحميل سلسلة الببتيد المتنامية والمركبات الطليعية المتعلقة.[98]

تعد ثلاثة إنزيمات مخلّقة ببتيدية لاريبوزومية (NRPSs) وهي VpsA و VpsB و VpsC مسؤولة عن تجميع الببتيد السباعي (طالع الشكل 2).[95] حيث يساهم VpsA في تشفير الوحدات 1 إلى 3، أما VpsB فيساهم في تشفير الوحدات 4 إلى 6؛ في حين أن الوحدة 7 تشفر عبر VpsC. يحتوي الجزء اللاسكري من الفانكوميسين على أربع أحماض أمينية D، على الرغم من أن الببتيدات اللاريبوزومية حاوية على ثلاثة نطاقات للتصاوغ الصنوي، إذ لا يعرف مصدر البقايا الطرفية من D-ليوسين. تكون الإنزيمات المخلقة الثلاثة متموضعة في بداية منطقة المجموع المورثي لبكتريا الشعية الفطرية القادرة على اصطناع الفانكوميسين حيوياً؛ وتمتد على مجال من 27 ألف زوج قاعدي.[95] لم يحدد بعد التوقيت الذي تحدث فيه عملية الكلورة بواسطة الإنزيم هالوجيناز VhaA أثناء عملية الاصطناع الحيوي، ولكن اقترح أن تحدث قبل إتمام عملية التجميع لسباعي الببتيد.[99] بعد اكتمال عملية الاصطناع الحيوي لسباعي الببتيد الخطي، ينبغي لجزيء فانكوميسين أن يخضع إلى تحويرات إضافية من أجل التحول إلى الشكل الحيوي الفعّال؛ وذلك يتم عبر تفاعلات تشابك تأكسدي وعبر غلكزة (الارتباط بالغليكوزيل) المحفزة من إنزيمات نوعية (طالع الشكل 3). من ضمن هذه الإنزيمات المساهمة في عملية التفعيل الحيوي إنزيمات أكسجيناز مثل OxyA و OxyB و OxyC و OxyD، وهي إنزيمات سيتوكروم بي450 لكل منها دور محدد، إذ يحفز OxyB التشابك التأكسدي بين البقايا الطرفية للأحماض الأمينية في الموقعين 4 و 6؛ ويحفز OxyA في الموقعين 2 و 4؛ ويحفز OxyC في الموقعين 5 و 7. تحدث عملية التشابك التأكسدي تلك في الوقت الذي يكون فيه هيكل سباعي الببتيد الجزيئي مرتبطاً برابطة تساهمية إلى نطاق PCP السابع؛ ويكون فعل إنزيمات أكسجيناز سيتوكروم بي450 نوعياً وفريداً في عملية الاصطناع الحيوي لهذا المضاد الحيوي.[100]
تظهر بعض من الإنزيمات ناقلة للغليكوزيل القادرة على غلكزة الفانكوميسين والببتيدات اللاريبوزومية المتعلقة قدرة ملحوظة على السماح بتداخلية التأثير؛ لذلك تستخدم في مجال الأبحاث من أجل تشكيل مكتبة من المشابهات البنيوية من خلال التوزيع العشوائي للسكريات.[101][102][103]
Remove ads
الاصطناع الكامل
نجح الباحثون من إجراء عملية اصطناع كامل للفانكوميسين، سواءً للجزء اللاسكري منه؛[104][105] أو للجزيء الكامل.[106] كان ديفيد إيفانز (David Evans) قد تمكن من ذلك أول مرة في أكتوبر 1998، ثم تلاه نيكولاو (KC Nicolaou) في ديسمبر 1998، ثم ديل بوغر (Dale Boger) في سنة 1999، وتمكن الأخير أيضاً في سنة 2020 من إجراء عملية اصطناع أكثر انتقائية.[104][107][108]
آلية العمل
الملخص
السياق

يستهدف الفانكوميسين تَخْليق جدار الخلية البكتيريَّة عبر الارتباط بالبنيَّة الأساسيَّة لجدار الخلية البكتيرية في البكتيريا إيجابية الغرام، سواءً أكانت من النوع الهوائي أو اللاهوائي.[20] وتحديدًا، يُكوّن الفانكوميسين روابط هيدروجينية مع ببتيد D-ألانيل-D-ألانين (D-Ala-D-Ala) الموجود في طَليعة الببتيدوغليكان، وهي أحد مكونات جدار الخلية البكتيرية.[21]
الببتيدوغليكان هو بَلْمَر يوفر الدعم الهيكلي لجدار الخلية البكتيرية. يُصطنع طَليعة الببتيدوغليكان في السيتوبلازم، ثم يُنقل عبر الغشاء السيتوبلازمي إلى الحيز المحيط بهذا الغشتاء، حيث يُجَمّع في جدار الخلية. تتضمن عملية التجميع نشاطين إنزيميين، هما «نقل الغليكوزيل» (بالإنجليزية: Transglycosylation) و«نقل الببتيد» (بالإنجليزية: Transpeptidation). تتضمن عملية «نقل الغليكوزيل» بلمرة طَليعة الببتيدوغليكان في سلاسل طويلة، بينما تتضمن عملية «نقل الببتيد» ارتباطًا تشابكيًا لهذه السلاسل لتشكيل بنيةٍ تشبه الشبكة ثلاثية الأبعاد.[21]
يثبط الفانكوميسين تخليق جدار الخلية البكتيرية عبر الارتباط بأساس الببتيد D-ألانيل-D-ألانين لطلائع الببتيدوغليكان، مما يمنع معالجته بواسطة ناقِلة الغليكوزيل، وبالتالي، يُعطل الفانكوميسين نشاط «نقل الغليكوزيل» في عملية تخليق جدار الخلية. يؤدي هذا التعطيل إلى نقصٍ وخللٍ في جدار الخلية، مما يجعل البكتيريا المتناسخة عرضةً للقوى الخارجية مثل الضغط الإسموزي، مما يمنعها من البقاء على قيد الحياة ويقضي عليها الجهاز المناعي.[21]
البكتيريا سلبية الغرام غير حساسةٍ للفانكوميسين نظرًا لاختلاف شكل جدارها الخلوي. يحتوي الغشاء الخارجي للبكتيريا سلبية الغرام على عديد السكاريد الشحمي، الذي يعمل حاجزًا يمنع اختراق الفانكوميسين. لهذا السبب، يُستخدم الفانكوميسين بشكلٍ رئيسي لعلاج الالتهابات التي تسببها البكتيريا إيجابية الغرام[21] (باستثناء بعض أنواع النيسريَّة غير البُنِّيَّة).[110][111]
يستطيع جزيء الفانكوميسين الكبير أليفٌ الماء تكوين روابط هيدروجينيَّة مع مجموعات D-ألانيل-D-ألانين الطرفيَّة لببتيدات NAM/NAG. يتكون هذا التفاعل في الظروف الاعتياديَّة من خمس نقاطٍ. يمنع ارتباط الفانكوميسين مع D-ألانيل-D-ألانين تخليق البوليمرات الطويلة إن-حمض أستيل الميوراميك (NAM) وإن-أسيتيل غلوكوز أمين (NAG) في جدار الخلية البكتيرية، وهي تشكل أساس جدار الخلية البكتيرية، كما يمنع البوليمرات الأساسيَّة من الارتباط التشابكي فيما بينها.[112]
Remove ads
زراعة الأنسجة النباتية
يُعد الفانكوميسين أحد المضادات الحيوية القليلة المستخدمة في زراعة الأنسجة النباتية للقضاء على عدوى البكتيريا إيجابية الغرام، كما أنَّ سُميته منخفضة نسبيًا على النباتات.[113][114]
التاريخ
الملخص
السياق
عُزل الفانكوميسين للمرة الأولى عام 1953 بواسطة إدموند كورنفيلد، والذي كان يعمل آنذاك لدى إيلي ليلي وشركاءه، من بكتيريا في عينة تربةٍ جمعها المبشر ويليام بوو من الأدغال الداخلية لجزيرة بورنيو.[15] سُمي الكائن الحي الذي أنتج الفانكوميسين لاحقًا باسم «Amycolatopsis orientalis».[12] كان الغرض الأصلي من الفانكوميسين هو علاج المكورات العنقودية الذهبية المقاومة للبنسلين.[12][19] كما أنَّ المُركب سمي بدايةً «المركب 05865»، وُأطلق عليه لاحقًا اسم «فانكوميسين».[12]
من المزايا التي ظهرت سريعًا للفانكوميسين أنَّ المكورات العنقودية لم تُطور مقاومةً كبيرةً له، وذلك على الرغم من مرورها المتكرر في أوساط زراعة تحتوي على الفانكوميسين. وقد أدى التطور السريع لمقاومة البنسلين لدى المكورات العنقودية إلى تسريع اعتماده من قِبل إدارة الغذاء والدواء الأمريكية. قامت شركة إيلي ليلي في عام 1958 بتسويق «هيدروكلوريد الفانكوميسين» لأول مرةٍ تحت الاسم التجاري «فانكوسين».[19]
لم يُصبح الفانكوميسين العلاج الأول للمكورات العنقودية الذهبية لعدة أسباب:
- يمتلك توافرًا حيويًا فمويًّا ضعيفًا، لذلك يجب إعطاؤه وريديًا لمعظم العداوى.
- طُوِّرت لاحقًا البنسلينات جزئية الاصطناع المقاومة للبيتا لاكتام، مثل الميثيسيلين (وما تبعه، النافسيلين والكلوكساسلين)، والتي تمتلك فعاليةً أفضل ضد المكورات العنقودية الذهبية المقاومة للميثيسيلين (MRSA).
- استُخدم في التجارب الأولى أشكالٌ أوليَّة وغير نقيةٍ من الدواء (طين المسيسيبي)، والتي وُجد أنها سامةٌ للأذن الداخليَّة والكلى.[115] أدت هذه النتائج إلى اعتبار الفانكوميسين دواءً يُلجأ إليه ملاذًا أخيرًا.[19]
منح إيلي ليلي وشركاءه في عام 2004 ترخيص «الفانكوسين» لشركة فيروفارما[الإنجليزية] [ملاحظة 1] في الولايات المتحدة، وشركة فلين فارما في المملكة المتحدة، وشركة أسبن فارماكير في أستراليا. انتهت صلاحية براءة الاختراع في أوائل ثمانينيات القرن العشرين، وأذنت إدارة الغذاء والدواء الأمريكية ببيع العديد من النسخ الجنيسة في الولايات المتحدة، وتشمل شركات بيونيش فارما، وباكستر هيلثكير، وساندوز، وأكورن[الإنجليزية]-سترايدز[الإنجليزية]، وهوسبيرا[الإنجليزية].[118]
الأبحاث
قد يؤدي الجمع بين مسحوق الفانكوميسين وغسول اليود والبوفيدون إلى تقليل خطر الإصابة بعدوى المفصل المحيط بالبدلة (الطرف الصناعي) في عمليات رأب مفصل الورك والركبة.[119]
الهوامش
- استَحوَذَت شركة شاير على شركة فيروفارما في نوفمبر من سنة 2014 مقابل 4.2 مليار دولار.[116] ثم لم تلبث إلا أن استُحوِذَت هي نفسها من قبل شركة تاكيدا الدوائية في يناير 2019.[117]
المراجع
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads



