শীর্ষ প্রশ্ন
সময়রেখা
চ্যাট
প্রসঙ্গ
পারদ
একটি তরল ধাতব মৌলিক পদার্থ উইকিপিডিয়া থেকে, বিনামূল্যে একটি বিশ্বকোষ
Remove ads
পারদ একটি মৌলিক পদার্থ যার প্রতীক Hg পারমাণবিক সংখ্যা ৮০। এটি একটি ভারী d-ব্লক মৌল এবং একমাত্র ধাতু যা আদর্শ তাপমাত্রা এবং চাপে তরল অবস্থায় থাকে। [১]
Remove ads
আবিষ্কার
বৈশিষ্ট্য

পারদ একটি ভারী, রুপালী সাদা ধাতু। অন্যান্য ধাতুর তুলনায় এর তাপ পরিবাহিতা কম কিন্তু তড়িত্ִ পরিবাহিতা বেশি।[২] ব্লক মৌল হওয়া সত্ত্বেও এর গলনাংক ও স্ফুটনাংক অস্বাভাবিকভাবে কম। এর কারণ কোয়ান্টাম মেকানিক্স দ্বারা ঠিকভাবে ব্যাখ্যা করা যায়। পারদের একটি বিশেষ ধরনের ইলেকট্রন বিন্যাস বিদ্যমান। এর ইলেকট্রন বিন্যাসে ইলেকট্রনসমূহ ক্রমান্বয়ে 1s, 2s, 2p, 3s, 3p, 3d, 4s, 4p, 4d, 4f, 5s, 5p, 5d, 6s অরবিটালে প্রবেশ করে। এরকম গঠনের কারণে এর পরমাণু থেকে ইলেকট্রন অপসারণ অনেক কঠিন হয়ে পড়ে। ফলে পারদের ধর্মের সাথে মৌলিক গ্যাসসমূহের সামন্জস্য দেখা যায়, যেমন এদের পরমাণুসমূহের মধ্যে দুর্বল আকর্ষণ বল থাকে তাই এরা কক্ষ তাপমাথাতেই তরল অবস্থায় থাকে।
Remove ads
যৌগসমূহ
পারদের কিছু উল্লেখযোগ্য যৌগঃ
- মারকারি অ্যালুমিনিয়াম ক্লোরাইড
- মারকারি বেনজোয়েট
- মারকিউরিক
- মারকারি বাই ক্লোরাইড
- মারকারি ক্লোরাইড
- মিল্ড মারকারি সায়ানাইড
- মারকারি আয়োডাইড
- হলুদ মারকারি প্রোটো-আয়োডাইড
- কালো দ্রবণীয় মারকারি অক্সাইড
- লাল মারকারি অক্সাইড
- হলুদ মারকারি অক্সাইড
- মারকারি সালফেট
- মিথাইল মার্কুরি (জৈব যৌগ) এবং বিষাক্ত
রাসায়নিক বিক্রিয়া
ব্যবহার

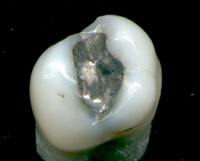
[
- দাঁতের ফিলিংয়ের উপাদান হিসেবে।
- ক্লোরিন ও কষ্টিক সোডা উৎপাদনে।
- পরীক্ষাগারের বিভিন্ন যন্ত্রপাতিতে। যেমনঃ থার্মোমিটারে তাপ গ্রাহক হিসেবে, এক ধরনের বিশেষ টেলিস্কোপে তরল প্রতিফলক হিসেবে।
- পারদ বাষ্প বিভিন্ন বাতিতে ব্যবহার করা হয়। যেমনঃ নিয়ন আলো, ফ্লুরোসেন্ট বাতি।
উৎস
প্রকৃতিতে অবস্থান: পারদ খুব দুষ্প্রাপ্য ধাতু। একটি একমাত্র তরল ধাতু। কাজেই এটি বেশ দামী। প্রকৃতিতে খুব অল্প পরিমাণই মুক্ত অবস্থায় বিরাজ করে। এর প্রধান উৎস হল এর সালফাইড আকরিক, সিনাবার (HgS) আকরিক। এই আকরিক স্পেন (পৃথিবীর ৮০%), ইতালি, অস্ট্রিয়া, ক্যালিফোর্নিয়া প্রভৃতি স্থানে পাওয়া যায়।
আরও দেখুন
তথ্যসূত্র
বহিঃসংযোগ
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads


