Top-Fragen
Zeitleiste
Chat
Kontext
Fettsäure-Synthase
Gruppe von Enzymen Aus Wikipedia, der freien Enzyklopädie
Remove ads
Die Fettsäure-Synthase (FAS) ist das Enzym, das in Säugetieren und Pilzen den Aufbau von Fettsäuren, besonders Palmitinsäure, aus Acetyl-CoA und Malonyl-CoA katalysiert. Dies ist der Hauptprozess der Lipogenese und lebenswichtig zur Speicherung von Energie in allen Organen und Körperteilen. Im Menschen wird besonders viel FAS in Gehirn, Lunge und Leber erzeugt.[1]
Der Syntheseprozess besteht aus sieben Einzelreaktionen, die sechsmal hintereinander in derselben Reihenfolge durchgeführt werden. Jede der Einzelreaktionen hat am Fettsäure-Synthase-Molekül ein eigenes katalytisches Zentrum. Es handelt sich also um ein multifunktionelles Enzym. Die genaue Lage dieser katalytischen Zentren zueinander ist Gegenstand der Forschung. In Pflanzen und Bakterien übernehmen einzelne Enzyme die Aufgabe der FAS.[2]
Remove ads
Klassen
Zusammenfassung
Kontext
Es gibt zwei Hauptklassen von Fettsäuresynthasen.
- Systeme des Typs I (FAS I) verwenden ein einziges großes, multifunktionelles Polypeptid und sind sowohl bei Tieren als auch bei Pilzen anzutreffen (obwohl sich die strukturelle Anordnung der Synthesen bei Pilzen und Tieren unterscheidet). Ein Fettsäuresynthasesystem vom Typ I findet sich auch in der CMN-Bakteriengruppe (Corynebakterien, Mykobakterien und Nocardien). In diesen Bakterien produziert das FAS-I-System Palmitinsäure und arbeitet mit dem FAS-II-System zusammen, um eine größere Vielfalt an Lipidprodukten zu erzeugen.[3]
- Systeme des Typs II (FAS II) kommen in Archaeen, Bakterien, Pflanzenplastiden sowie in den Mitochondrien von Tieren, einschließlich des Menschen, vor und sind durch die Verwendung separater, monofunktioneller Enzyme für die Fettsäuresynthese gekennzeichnet. Inhibitoren dieses Weges (FAS II) werden als mögliche Antibiotika untersucht.[4]
Der Mechanismus der Elongation und Reduktion von FAS I und FAS II ist derselbe, da die Domänen der FAS-II-Enzyme weitgehend homolog zu ihren Gegenstücken in den FAS-I-Multienzym-Polypeptiden sind. Die Unterschiede in der Organisation der Enzyme – integriert in FAS I, separat in FAS II – führen jedoch zu vielen wichtigen biochemischen Unterschieden.[5]
Die Entwicklungsgeschichte der Fettsäuresynthasen ist eng mit der der Polyketidsynthasen (PKS) verflochten. Polyketidsynthasen nutzen einen ähnlichen Mechanismus und homologe Domänen zur Herstellung von Sekundärmetaboliten-Lipiden. Darüber hinaus weisen Polyketidsynthasen auch eine Typ-I- und Typ-II-Organisation auf. Es wird angenommen, dass FAS I in Tieren durch eine Modifikation von PKS I in Pilzen entstanden ist, während FAS I in Pilzen und der CMN-Gruppe von Bakterien anscheinend separat durch die Fusion von FAS II-Genen entstanden ist.[3]
Remove ads
Aufbau
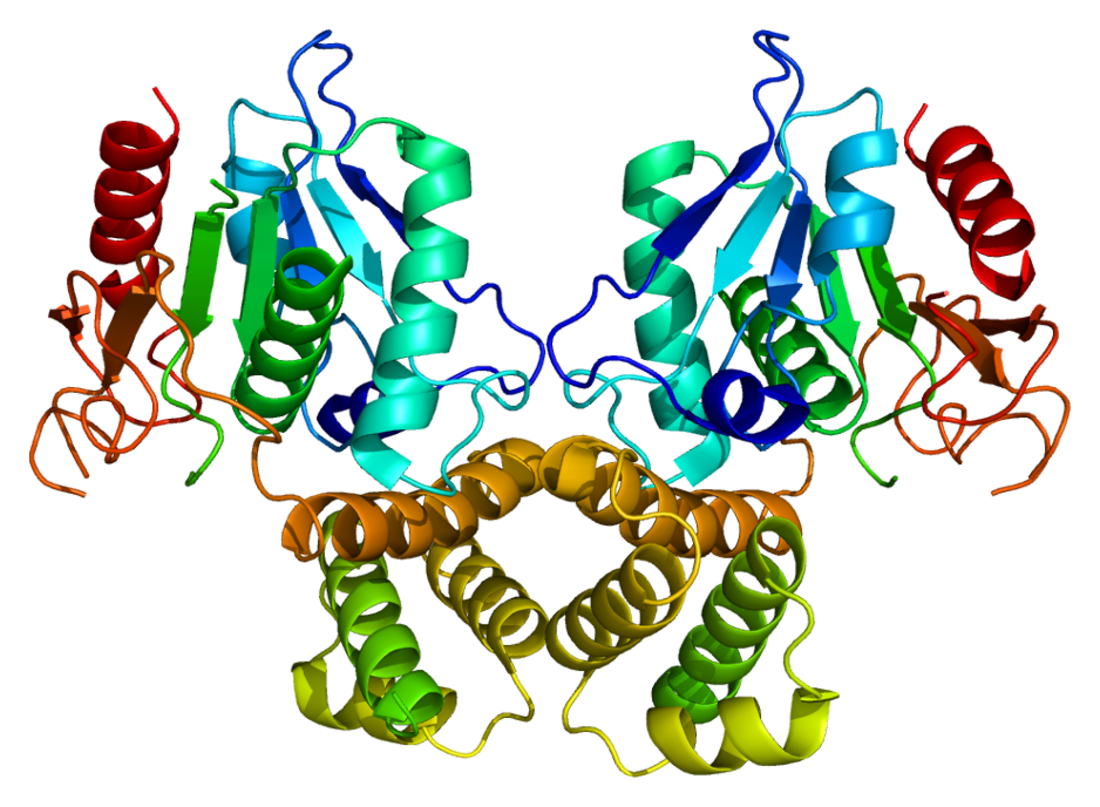
Als homodimeres und multifunktionelles Enzym besteht die Fettsäure-Synthase aus zwei antiparallel gelegenen Untereinheiten, die jeweils sieben Domänen besitzen – sechs davon sind katalytisch aktiv. Die katalytisch inaktive Domäne bildet die Acyl-Carrier-Protein-Domäne (ACP-Domäne): Sie ist für die Bindung der Fettsäuren über Thiolgruppen an die FAS zuständig. Die an der Katalyse der Fettsäuresynthese beteiligten Domänen sind die Transacylase, das condensing enzyme (CE), die Ketoacyl-Reduktase, Dehydratase, Enoyl-Reduktase und Thioesterase, welche am Ende der Synthese die hydrolytische Freisetzung der Fettsäure von der ACP-Domäne katalysiert.[6]
Remove ads
Regulation
Die FAS wird in vielen Tumor-Zelllinien überexprimiert, ebenso bei Hepatitis B- und Hepatitis-C-Virusinfektion; FAS-Hemmung führt außerdem zu verringerter HC-Virusreplikation. Es wird vermutet, dass gesundheitsfördernde Wirkungen von Pflanzenstoffen wie Epigallocatechin-3-gallat (Grüner Tee) oder Farnesol und Inhaltsstoffen aus Olivenöl auf einer Hemmung der FAS beruhen. Die Fettsäure-Synthase ist damit interessantes Target für die Pharmaindustrie.[7][8][9][10][11][12][13]
Expression der FAS wird durch SREBP-1c angeregt, das seinerseits bei Sauerstoffmangel blockiert wird – dann wird durch Herunterfahren der aufwändigen Fettsäuresynthese Energie gespart. In der Zellmembran lokalisierte FAS ist mit Caveolin-1 assoziiert.[14][15]
Katalysierter Prozess
Siehe Artikel Fettsäuresynthese.
Einzelnachweise
Weblinks
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads