Top-Fragen
Zeitleiste
Chat
Kontext
Metastabilität
physikalisch-chemische Dynamik Aus Wikipedia, der freien Enzyklopädie
Remove ads
Metastabilität in der Physik und der Chemie ist eine schwache Form der Stabilität. Ein metastabiler Zustand ist stabil gegen kleine Änderungen, jedoch instabil gegenüber größeren Änderungen. Das Compendium of Chemical Terminology (Gold Book) definiert Metastabilität als lokales Minimum der molaren Gibbs-Energie.[1]


In der Quantenphysik werden Zustände mit sehr geringer Wahrscheinlichkeit für den Übergang in einen anderen Zustand, also solche mit langer Lebensdauer, als „metastabil“ bezeichnet.
Remove ads
Klassische Physik und Chemie
Zusammenfassung
Kontext
Ein Beispiel dafür ist das System Kohlenwasserstoffe und Luftsauerstoff bei Raumtemperatur: Aus thermodynamischer Sicht würde die spontane Verbrennung des darin chemisch gebundenen Kohlenstoffs und Wasserstoffs zu Kohlenstoffdioxid und Wasser zu einem stabileren, energieärmeren Zustand führen. Bei Raumtemperatur findet die Reaktion aber nicht statt, sondern es muss zuerst eine gewisse Mindestenergie (Aktivierungsenergie) aufgebracht werden. Die Aktivierungsenergie wird z. B. zum Anzünden einer Kerze benötigt, erst nach dem Übergang des Kerzenwachses vom festen in den gasförmigen Zustand sowie der Erwärmung der Gase auf die Zündtemperatur beginnt die eigentliche chemische Reaktion, hier also die Verbrennung des Kerzenwachses. Wird die Energiezufuhr vorher unterbrochen, kühlt das Wachs wieder ab und die Reaktion findet nicht statt.[2]
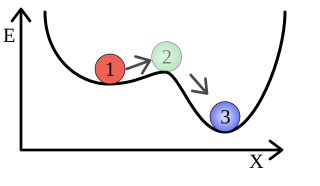
Anschaulich dargestellt ist das im Bild rechts: Ein Ball liegt in einer kleinen Mulde an einem Berghang. Solange der Ball nur wenig in der Mulde ausgelenkt wird, rollt er an ihre tiefste Stelle zurück. Diese stellt ein lokales Minimum der inneren Energie dar. Wird er aber stärker ausgelenkt, kann er den Berghang hinunterrollen und das nächste lokale Minimum erreichen.
Metastabile Phasen haben eine höhere Energie (korrekter: Freie Enthalpie – unter definierten Bedingungen wie konstanter Druck und konstante Temperatur) als die stabile Phase. Auf Grund einer hohen Aktivierungsenergie wandeln sie sich nicht oder nur langsam in die stabile Phase um.[3] Dieses energetische Grundprinzip metastabiler Zustände kann auch als Methode zur Energiespeicherung nutzbar gemacht werden,[4] wie es prinzipiell beispielsweise auch in Latentwärmespeichern geschieht.
Ein Beispiel für eine metastabile Phase ist der Diamant, der sich bei Atmosphärendruck spontan in Graphit verwandeln sollte; die Geschwindigkeit dieses Vorgangs ist allerdings bei Zimmertemperatur verschwindend klein. Ein anderes Beispiel ist die Zinnpest: Die metallische Phase des Zinns wird unterhalb von 13 °C metastabil und wandelt sich langsam in die bei diesen Temperaturen stabilere nichtmetallische Phase um.[5] Weitere Beispiele sind unterkühltes Wasser, amorphes Material wie Glas (der stabilste Zustand wären die kristallinen Silikate) und übersättigte Lösungen, die zum Beispiel in Handwärmern Verwendung finden.
Remove ads
Quantenphysik
In der Quantenphysik und insbesondere der Atomphysik und Quantenoptik werden Zustände als metastabil bezeichnet, die zwar nicht stationäre Zustände der jeweils betrachteten Dynamik sind, aber verglichen mit deren Zeitskala eine lange Lebensdauer haben. Beispiele sind angeregte Zustände von Atomen, deren spontaner Zerfall durch Auswahlregeln verlangsamt wird.[6][7]
Analog werden in der Kernphysik langlebige angeregte Zustände (Kernisomere) ebenfalls als metastabil bezeichnet.[8]
Remove ads
Siehe auch
Einzelnachweise
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads
