Κυκλοπροπάνιο
From Wikipedia, the free encyclopedia
Remove ads
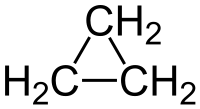
Το κυκλοπροπάνιο (αγγλικά: cyclopropane) είναι οργανική χημική ένωση με μοριακό τύπο C3H6, αλλά συνήθως παριστάνεται με το γραμμικό του τύπο, που μοιάζει με ένα ισόπλευρο τρίγωνο (![]() ). Είναι το απλούστερο κυκλοαλκάνιο, δηλαδή κορεσμένος υδρογονάνθρακας με ένα δακτύλιο ανά μόριο. Το μόριό του περιέχει τρία (3) άτομα άνθρακα που σχηματίζουν τριμελή δακτύλιο, καταλήγοντας σε μοριακή συμμετρία D3h. Καθένα από αυτά τα άτομα άνθρακα είναι ενωμένο με δύο (2) άτομα υδρογόνου. Το κυκλοπροπάνιο έχει μόνο ένα (1) (σταθερό) ισομερές θέσης, το προπένιο, αλλά είναι ισομερές και με δύο (2) καρβένια, το 1-προπυλιδένιο (CH3CH2CH:) και το 2-προπυλιδένιο [(CH3)2C:].
). Είναι το απλούστερο κυκλοαλκάνιο, δηλαδή κορεσμένος υδρογονάνθρακας με ένα δακτύλιο ανά μόριο. Το μόριό του περιέχει τρία (3) άτομα άνθρακα που σχηματίζουν τριμελή δακτύλιο, καταλήγοντας σε μοριακή συμμετρία D3h. Καθένα από αυτά τα άτομα άνθρακα είναι ενωμένο με δύο (2) άτομα υδρογόνου. Το κυκλοπροπάνιο έχει μόνο ένα (1) (σταθερό) ισομερές θέσης, το προπένιο, αλλά είναι ισομερές και με δύο (2) καρβένια, το 1-προπυλιδένιο (CH3CH2CH:) και το 2-προπυλιδένιο [(CH3)2C:].
Το κυκλοπροπάνιο έχει ιδιότητες αναισθητικού, όταν εισπνέεται, αλλά στη σύγχρονη αναισθητική πρακτική έχει ξεπεραστεί από άλλα αναισθητικά μέσα, ενώ αποφεύγεται η χρήση του για το σκοπό αυτό, γιατί η εξαιρετική του χημική δραστικότητα το καθιστά επικίνδυνο. Άλλωστε, όταν το αέριο αυτό αναμειγνύεται με οξυγόνο, υπάρχει και ένας σημαντικός κίνδυνος έκρηξης.
Remove ads
Ονοματολογία
Η ονομασία «κυκλοπροπάνιο» προέρχεται από την ονοματολογία κατά IUPAC. Συγκεκριμένα, το πρόθεμα της κύριας ονομασίας «προπ-» δηλώνει την παρουσία τριών (3) ατόμων άνθρακα ανά μόριο της ένωσης, το ενδιάμεσο «-αν-» δείχνει την παρουσία μόνο απλών δεσμών μεταξύ ατόμων άνθρακα στο μόριο και η κατάληξη «-ιο» φανερώνει ότι δεν περιέχει χαρακτηριστικές ομάδες, δηλαδή ότι είναι υδρογονάνθρακας. Το αρχικό πρόθεμα «κυκλο-» δηλώνει την παρουσία ενός (1) ισοκυκλικού δακτυλίου στο μόριο της ένωσης.
Remove ads
Ιστορία
Το κυκλοπροπανιο ανακαλύφθηκε το 1881, από τον Αυγκούστ Φρέουντ (August Freund), που πρότεινε τη σωστή δομή για τη νέα (τότε) ένωση στις πρώτες κιόλας αναφορές του. Ο Αυγκούστ Φρέουντ επέδρασε νάτριο σε 1,3-διβρωμοπροπάνιο. Η χημική αντίδραση που ακολούθησε είναι μια ενδομοριακή αντίδραση Βουρτζ (Wurtz reaction), που οδηγεί απευθείας σε κυκλοπροπάνιο[1][2]. Η απόδοση της αντίδρασης μπορεί να βελτιωθεί με τη χρήση ψευδαργύρου αντί νατρίου[3]. Το κυκλοπροπάνιο δεν είχε εμπορική εφαρμογή μέχρι που οι Χέντερσον (Henderson) και Λούκας (Lucas) ανακάλυψαν τις αναισθητικές του ιδιότητες το 1929[4]. Η βιομηχανική του παραγωγή άρχισε από το 1936[5].
Remove ads
Δομή


Η ισόπλευρη τριγωνική δομή του κυκλοπροπανίου απαιτεί οι δεσμικές γωνίες C-C-C να είναι 60°. Η γωνία αυτή είναι πολύ μικρότερη από την πλέον σταθερή, θερμοδυναμικά, δεσμική γωνία των περίπου 109.5°, των δεσμών σ μεταξύ υβριδικών τροχιακών sp³-sp³. Αυτό οδηγεί στην ύπαρξη σημαντικής παραμόρφωσης δακτυλίου. Το μόριο έχει επίσης και παραμόρφωση στρέψης, εξαιτίας της εκλειπτικής διαμόρφωσης των ατόμων υδρογόνου του. Για τους παραπάνω λόγους, οι χημικοί δεσμοί μεταξύ των ατόμων άνθρακα του κυκλοπροπανίου είναι σχετικά ασθενέστεροι από τους τυπικούς δεσμούς C-C ενός τυπικού αλκανίου, οδηγώντας σε πολύ μεγαλύτερη χημική δραστικότητα (σε σύγκριση με τα αλκάνια).
Η δεσμολογία μεταξύ των ατόμων άνθρακα γενικά περιγράφεται με τους όρους των δεσμών με κάμψη (bent bonds)[6]. Σύμφωνα με αυτό το μοντέλο, οι δεσμοί άνθρακα - άνθρακα στο κυκλοπροπάνιο κάμπτονται έτσι ώστε να σχηματίζεται μια ενδοτροχιακή γωνία των 104°. Αυτό ελαττώνει το επίπεδο της παραμόρφωσης δακτυλίου στρεβλώνοντας τον sp3 υβριδισμό των ατόμων άνθρακα έτσι ώστε να έχουν μεγαλύτερο π χαρακτήρα από το κανονικό[7], ενώ από την άλλη οι δεσμοί άνθρακα - υδρογόνου αποκτούν μεγαλύτερο σ χαρακτήρα, από το κανονικό. Μια ασυνήθιστη συνέπεια της δεσμολογίας με κάμψη είναι ότι ενώ οι δεσμοί C-C, είναι ασθενέστεροι από το κανονικό, τα άτομα άνθρακα βρίσκονται κοντύτερα το ένα με το άλλο, σε σύγκριση με έναν κανονικό απλό δεσμό αλκανίων: Πιο συγκεκριμένα, βρίσκονται σε απόσταση 151 pm αντί για το κανονικό που είναι 153 pm. Λάβετε υπόψη, ακόμη, ότι ο μέσος όρος για τα αλκένια είναι 146 pm[8].
Ένα εναλλακτικό μοντέλο περιγραφής της δεσμολογίας του κυκλοπροπανίου περιλαμβάνει διαγράμματα Γουάλς (Walsh diagrams) και στοχεύει να κάνει καλύτερη δουλειά ώστε να ταιριάζει η θεωρία μοριακών τροχιακών, υπό το φως των φασματοσκοπικών ενδείξεων και των επιχειρημάτων της συμμετρίας ομάδας. Σε αυτό το μοντέλο, το μόριο του κυκλοπροπάνιο περιγράφεται με τη χρήση δεσμικού τροχιακού συνδυασμού τριών κέντρων τριών (3) καρβενίων μεθυλενίου.
Ο κυκλικός απεντοπισμός των έξι (6) ηλεκτρονίων των τριών (3) C-C σ δεσμών δόθηκε από τον Μάικλ Ντιούαρ (Michael J. S. Dewar) ως μια εξήγηση της σχετικά μικρή ενέργεια παραμόρφωσης, σε σύγκριση με την αντίστοιχη του κυκλοβουτανίου (μόνο 27,6 έναντι 26,2 kcal/mol), με το κυκλοεξάνιο ως ένωση αναφοράς με Estr = 0 kcal/mol[9]. Αυτή η (σχετική) σταθεροποίηση αναφέρεται ως «αρωματικότητα σ»[10][11]. Η παραδοχή ενός διαμαγνητικού δακτυλικού ρεύματος στο κυκλοπροπάνιο ευθυγραμμίζεται με την «προστασία» των πρωτονίων στη φασματοσκοπία πυρηνικού μαγνητικού συντονισμού και στις ασυνήθιστες μαγνητικές ιδιότητες του κυκλοπροπανίου, που περιλαμβάνουν υψηλή διαμαγνητική ευαισθησία και υψηλή ανισοτροπία της διαμαγνητικής ευαισθησίας. Πιο πρόσφατες έρευνες που ενισχύουν την υπόθεση ότι το κυκλοπροπάνιο σταθεροποιείται από μια αρωματικότητα αποδίδουν μια σταθεροποίηση της τάξης των 11,3 kcal/mol από αυτό το φαινόμενο[12].
Ύστερα από ενεργειακή ανάλυση των πιθανών δομών - μοριακών μοντέλων με κβαντομηχανικές μεθόδους προέκυψε ως πιθανότερη η εκδοχή του sp2 υβριδισμού και της δημιουργίας δύο μοριακών τροχιακών τριών κέντρων (των τριών ατόμων C), σ (2sp2-2sp2-2sp2) και π (2p-2p-2p), με 3 ηλεκτρόνια ανά μοριακό τροχιακό, ώστε να χρησιμοποιηθούν τα 6 διαθέσιμα ηλεκτρόνια των 3 ατόμων C (τα άλλα 6 χρησιμοποιούνται για τους 6 σ δεσμούς με τα 6 άτομα υδρογόνου ή και με τα αλκύλια). Αντί δηλαδή των κλασσικών 3 ομοιοπολικών δεσμών δύο κέντρων μεταξύ των ατόμων C, υπάρχουν 2 ομοιοπολικοί δεσμοί τριών κέντρων[13].
Εξαιτίας αυτού του γεγονότος προκύπτει η λεγόμενη «ενέργεια τάσης δεσμών» που συνυπολογίζει την ενέργεια παραμόρφωσης δεσμικής γωνίας (κατά Baeyer), που οφείλεται στη διαφορά γωνίας από την κανονική, και την ενέργεια στρέψης (κατά Piltzer), που οφείλεται στην αδυναμία του συστήματος να στρέψει τους δεσμούς του και να πάρει διαμόρφωση αποφυγής των απώσεων τύπου Van der Waals, που αναπτύσσονται από την προσέγγιση αλληλαπωθούμενων ατόμων και ομάδων αυτών. Ενώ λοιπόν το ισομερές προπένιο έχει θερμότητα ολικής καύσης 1.971 kcal/mole το κυκλοπροπάνιο έχει 2.088 kcal/mole. Το ΔQ = 117 kJ/mole αντιστοιχεί ακριβώς στην επιπλέον ενέργεια που παγιδεύει η ιδιάζουσα δομή του τριμελή δακτυλίου[14].
Αποτέλεσμα των παραπάνω είναι τα κυκλοπροπάνια να δίνουν αντιδράσεις 1,3-προσθήκης με κυκλοδιάσπαση.
Κυκλοπροπάνια
Τα «κυκλοπροπάνια» είναι κατηγορία οργανικών ενώσεων. Η κατηγορία περιλαμβάνει το «μητρικό» κυκλοπροπάνιο καθώς αλλά και όλες τις «θυγατρικές» ενώσεις που περιέχουν έναν τουλάχιστον τριμελή δακτύλιο κυκλοπροπανίου. Οι πλευρικές αλυσίδες, όταν υπάρχουν, διαμορφώνονται όπως στα αλκάνια. Η δομή του κυκλοπροπανικού δακτυλίου περιγράφεται παραπάνω. Η απλούστερη πολυκυκλική ένωση που περιέχει πολλαπλούς συμπυκνωμένους δακτυλίους πολυπροπανίου είναι το τετραεδράνιο, που το μόριό του αποτελείται από τέσσερις (4) κυκλοπροπανικούς δακτυλίους που σχηματίζουν τις έδρες ενός τετραέδρου. Ακόμη, το [1.1.1]-προπελάνιο περιέχει τρεις (3) κυκλοπροπανικούς δακτυλίους που μοιράζονται ένα κοινό κεντρικό ζεύγος ατόμων άνθρακα και το δεσμό τους.
- [1.1.1]-προπελάνιο
Remove ads
Παραγωγή
Ενδομοριακή αντίδραση Würz
Ιστορικά πρωτοπαρασκευάστηκε από τον August Freund το 1881 με τη χρήση ενδομοριακής αντίδρασης Würtz, από 1,3-διβρωμοπροπάνιο[16][17]
- Όμως η απόδοση αυτής της αντίδρασης είναι σχετικά μικρή, αφού ταυτόχρονα διεξάγεται αναπόφευκτα και διαμοριακή[18]:
Αιθένιο και μεθυλένιο
Λόγω της τάσης χρήσης του αιθενίου ως κεντρική πρώτη ύλη της οργανικής χημείας, επικράτησε περισσότερο η προσθήκη του κατάλληλου καρβενίου σ' αυτό, δηλαδή του μεθυλενίου, που παράγεται επί τόπου από CH3Cl και KOH. Η στοιχειομετρική εξίσωση της αντίδρασης είναι[21]:
Remove ads
Χημικές ιδιότητες
- Τα κυκλοαλκάνια με τριμελή δακτύλιο (δηλαδή τα «κυκλοπροπάνια») έχουν αρκετή ενέργεια τάσης δεσμών για να δώσουν 1,3-προσθήκη με κυκλοδιάσπαση, αλλά κάτω από πιο έντονες συνθήκες και με μικρότερη ταχύτητα αντίδρασης σε σχέση με τα αλκένια. Κατά τα άλλα συμπεριφέρονται χημικά όπως τα αλκάνια[23]:
Οξείδωση
1. Όπως όλα τα κυκλοαλκάνια, το κυκλοπροπάνιο με περίσσεια οξυγόνου καίγεται προς διοξείδιο του άνθρακα και νερό[24][25]:
2. Παραγωγή υδραερίου:
3. Καταλυτική οξείδωση:
- 1. Χωρίς κυκλοπροσθήκη προς κυκλοπροπανόνη:
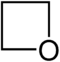
- 2. Με πιο έντονες συνθήκες δίνει οξετάνιο:
Αλογόνωση
1. Φωτοχημική αλογόνωση υποκατάστασης υδρογόνου: Το κυκλοπροπάνιο έχει 6 ισότιμα άτομα υδρογόνου, που μπορούν να χρησιμοποιηθούν για φωτοχημική αντικατάσταση από αλογόνα, οπότε προκύπτει ένα μόνο κυκλοπροπυλαλογονίδιο[29]:
- Δραστικότητα των X2: F2 > Cl2 > Br2 > Ι2.
Ανάλυση του μηχανισμού της χλωρίωσης του κυκλοπροπανίου:
- 1. Έναρξη: Παράγονται ελεύθερες ρίζες:
- Η απαιτούμενη ενέργεια προέρχεται από το υπεριώδες φως (UV) ή θερμότητα (Δ).
- 2. Διάδοση: Καταναλώνονται οι παλιές ελεύθερες ρίζες, σχηματίζοντας νέες.
- 3. Τερματισμός: Καταναλώνονται μεταξύ τους οι ελεύθερες ρίζες, κατά τη στατιστικά σπάνια περίπτωση της συνάντησής τους.
- Είναι όμως πρακτικά δύσκολο να σταματήσει η αντίδραση στην παραγωγή μονοαλογονοπαραγώγων.
- Αν χρησιμοποιηθούν ισομοριακές ποσότητες
 και Χ2 θα παραχθεί μείγμα όλων των X-παραγώγων του
και Χ2 θα παραχθεί μείγμα όλων των X-παραγώγων του 
- Αν όμως χρησιμοποιηθεί περίσσεια
 , τότε η απόδοση των μονοπαραγώγων αυξάνεται πολύ, λόγω της αύξησης της στατιστική πιθανότητας συνάντησης
, τότε η απόδοση των μονοπαραγώγων αυξάνεται πολύ, λόγω της αύξησης της στατιστική πιθανότητας συνάντησης  με X. σε σχέση με την πιθανότητα συνάντησης μονοπαραγώγου και X., που μπορεί να οδηγήσει στην παραγωγή των υπόλοιπων X-παραγώγων.
με X. σε σχέση με την πιθανότητα συνάντησης μονοπαραγώγου και X., που μπορεί να οδηγήσει στην παραγωγή των υπόλοιπων X-παραγώγων.
- Αν χρησιμοποιηθούν ισομοριακές ποσότητες
2. Με 1,3-κυκλοπροσθήκη παράγεται 1,3-διαλοπροπάνιο:
Επίδραση καρβενίων
- Το κυκλοπροπάνιο έχει 6 ισότιμα, για παρεμβολή καρβενίων, άτομα υδρογόνου, οπότε προκύπτει ένα μόνο προϊόν. Π.χ. με επίδρση μεθυλενίου παράγεται μεθυλοκυκλοπροπάνιο[31]:
Νίτρωση
Καταλυτική 1,3-υδρογόνωση
Με καταλυτική υδρογόνωση - Παράγεται προπάνιο[33]:
1,3-υδραλογόνωση
Με υδραλογόνο (ΗΧ) - Παράγεται προπυλοαλογονίδιο:
1,3-Υδροξυαλογόνωση
Με υπαλογονώδες οξύ (HOX) - Παράγεται 3-αλο-1-προπανόλη:
1,3-ενυδάτωση
Με επίδραση θειικού οξέως σε κυκλοπροπάνιo παράγεται ο μονοπροπυλεστέρας του θειικού οξέος, που υδρολύεται σχηματίζοντας 1-προπανόλη:
1,3-διυδροξυλίωση
Με επίδραση υπεροξείδιο του υδρογόνου σε κυκλοπροπάνιo, παρουσία καρβοξυλικών οξέων παράγεται 1,3-προπανoδιόλη:
Remove ads
Εφαρμογή ως αναισθητικό
Το κυκλοπροπάνιο χρησιμοποιήθηκε για πρώτη φορά σε κλινική χρήση από τον Αμερικανό αναισθησιολόγο Ραλφ Γουάτερς (Ralph Waters), που χρησιμοποίησε ένα κλειστό σύστημα με απορρόφηση διοξειδίου του άνθρακα για να τη φύλαξη αυτού του ακριβού (τότε) μέσου. Το κυκλοπροπάνιο είναι ένα σχετικά ισχυρό, μη ερεθιστικό και με γλυκιά οσμή αέριο (υπό συνηθισμένες συνθήκες) με ελάχιστη κυψελιδική συγκέντρωση 17,5%[34] και συντελεστή κατανομής αερίων αίματος 0,55. Αυτό σημαίνει ότι η αναισθησία με εισπνοή κυκλοπροπανίου και οξυγόνου είναι γρήγορη και όχι δυσάρεστη. Ωστόσο το συμπέρασμα από την παρατεταμένη αναισθησία ασθενών, που υποβλήθηκαν σε αναισθησία από κυκλοπροπάνιο, ήταν ότι μπορεί να υπέφεραν από ξαφνική μείωση της πίεσης αίματος, που μπορούσε να οδηγήσει σε καρδιακή δυσρυθμία, μια αντίδραση που έγινε γνωστή ως «σοκ κυκλοπροπανίου» (cyclopropane shock)[35]. Για το λόγο αυτό, αλλά και εξαιτίας του υψηλού του οικονομικού κόστους και της εκρηκτικής του φύσης[36], πρόσφατα χρησιμοποιούνταν μόνο για την επαγωγή της αναισθησίας, πριν σταματήσει τελείως η χρήση του ως αναισθητικό. Οι κύλινδροι και μετρητές ροής είχαν ένα ενδεικτικό πορτοκαλί χρώμα.
Φαρμακολογία
Το κυκλοπροπάνιο είναι ανενεργό για τους υποδοχείς GABAA και γλυκίνης, αλλά δρα σε έναν ανταγωνιστικό υποδοχέα NMDA[37][38]. Επίσης, εμποδίζει τον υποδοχέα AMPA και τους υποδοχείς νικοτινικής ακετυλοχολίνης, και ενεργοποιεί αρκετά κανάλια K2P[39][37][38]
Remove ads
Ασφάλεια
Το κυκλοπροπάνιο είναι πολύ εύφλεκτο. Ωστόσο, παρά την ενέργεια παραμόρφωσής του, δεν είναι πιο εκρηκτικό σε σύγκριση με τα αλκάνια.
Πηγές
- Ν. Αλεξάνδρου, Γενική Οργανική Χημεία, ΘΕΣΣΑΛΟΝΙΚΗ 1985
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
Αναφορές και παρατηρήσεις
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads














![{\displaystyle \mathrm {+3H_{2}O{\xrightarrow[{700-1100^{o}C}]{Ni}}3CO+6H_{2}} }](http://wikimedia.org/api/rest_v1/media/math/render/svg/4092ba3a99c06c6660e229ed6517eb6aa67c6ac2)
![{\displaystyle \mathrm {+O_{2}{\xrightarrow[{\triangle }]{Cu}}H_{2}O+} }](http://wikimedia.org/api/rest_v1/media/math/render/svg/5ad0e766c90ff9dd6d78efd9e1c5ab564423ca9e)
![{\displaystyle \mathrm {+{\frac {1}{2}}O_{2}{\xrightarrow[{1-2MPa,\;280^{o}C}]{Ag}}} }](http://wikimedia.org/api/rest_v1/media/math/render/svg/d7c6afaa463770e8f338d24528e88bab69cf21d9)
![{\displaystyle \mathrm {+X_{2}{\xrightarrow[{\triangle }]{UV}}HX+} }](http://wikimedia.org/api/rest_v1/media/math/render/svg/32d971c77e4c7bf3933a6b8058fff314dd3f149a)
![{\displaystyle \mathrm {Cl_{2}{\xrightarrow[{\triangle }]{UV}}2Cl^{\bullet }-239kJ} }](http://wikimedia.org/api/rest_v1/media/math/render/svg/73fe9c8e7397e9e50d5b5a7ea91a25e26bed2f96)















![{\displaystyle \mathrm {+H_{2}SO_{4}\xrightarrow {} CH_{3}CH_{2}CH_{2}OSO_{3}H{\xrightarrow[{-H_{2}SO_{4}}]{+H_{2}O}}CH_{3}CH_{2}CH_{2}OH} }](http://wikimedia.org/api/rest_v1/media/math/render/svg/c7eb661ef73415051303afa182b8fab34848af08)
