Top Qs
Línea de tiempo
Chat
Contexto
Óxido de berilio
compuesto químico De Wikipedia, la enciclopedia libre
Remove ads
El óxido de berilio es un compuesto sólido inorgánico con la fórmula BeO. Se trata de un aislante eléctrico incoloro, con una conductividad térmica más alta que cualquier otro no metal, exceptuando el diamante. Su alto punto de fusión conduce a su uso como un refractario.[2] Se produce en la naturaleza como bromelita. Histórica y científicamente se llamaba glucina u óxido de glucinio.
Remove ads
Preparación
El óxido de berilio se puede preparar por calcinación de carbonato de berilio, deshidratación de hidróxido de berilio, o por ignición del metal:
BeCO3 → BeO + CO2
Be(OH)2 - H2O → BeO
2Be + O2 → 2BeO
Al quemar berilio en presencia de aire se produce una mezcla de BeO y nitruro de berilio (Be3N2). A diferencia de los óxidos formados por el grupo de los metales alcalinotérreos, el óxido de berilio es anfótero.
El óxido de berilio formado a altas temperaturas (mayores a 800 °C) es inerte, pero se disuelve fácilmente en bifluoruro de amonio acuoso caliente (NH4HF2), o una solución caliente de ácido sulfúrico concentrado y sulfato de amonio ((NH4)2SO4).
Remove ads
Estructura
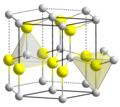
El BeO cristaliza en la estructura de wurtzita hexagonal, con Be2 + y O2 en centros tetraédricos. En contraste, los óxidos del grupo más grande de metales, es decir, MgO, CaO, SrO, BaO, cristalizan bajo la forma de sal de roca de estructura cúbica con geometría octaédrica sobre los dicationes y dianiones. A temperaturas elevadas, se transforma a la estructura tetragonal,[3] como equipos de radio. También se emplea en ciertos materiales de interfaz térmica (como pastas térmicas),[4] así como en disipadores de calor y capas de difusión térmica para componentes electrónicos como CPUs, láseres y amplificadores de potencia.[5]
En la fase vapor, el óxido de berilio está presente como moléculas diatómicas discretas, las cuales adoptan la hibridación del orbital sp, con dos sigma y dos enlaces pi. El estado fundamental correspondiente es: (2sσ) 2 (2sσ *) 2 (2pπ) 4, donde ambos orbitales π degenerados pueden ser considerados como enlaces dativos de oxígeno hacia el berilio.[6]
Remove ads
Aplicaciones
Los cristales de alta calidad se pueden hacer crecer hidrotérmicamente, o por el método de Verneuil. En su mayor parte, el óxido de berilio se produce como un polvo amorfo de color blanco, sinterizado en formas más grandes. Las impurezas como el carbono, atrapado en los cristales pueden dar una variedad de colores para esta sustancia.[7] El óxido de berilio se utiliza en motores de cohetes y también en semiconductores de alto rendimiento para equipos de radio, debido a su buena conductividad térmica por ser al mismo tiempo un buen aislante eléctrico.
Asimismo, es usado como un relleno en algunos materiales de interfaz térmica tales como la grasa térmica. Algunos dispositivos semiconductores de potencia han utilizado cerámica de óxido de berilio entre el chip de silicio y la base de montaje de metal del paquete, con el fin de lograr un menor valor de resistencia térmica que el obtenido para un dispositivo similar hecho con óxido de aluminio.[8] También se emplea como una cerámica estructural para dispositivos de microondas de alto rendimiento, los tubos de vacío, magnetrones, y láseres de gas.
Riesgos
El óxido de berilio es cancerígeno y puede causar enfermedades crónicas. Una vez obtenido en forma sólida, es seguro de manejar siempre y cuando no se someta a cualquier operación mecanizada que genere polvo.[9]
Véase también
Referencias
Enlaces externos
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads