Top Qs
Línea de tiempo
Chat
Contexto
Infección congénita por citomegalovirus
transmisión de madre a hijo del citomegalovirus durante el periodo prenatal De Wikipedia, la enciclopedia libre
Remove ads
El citomegalovirus congénito (cCMV, por sus siglas en inglés) es un grupo de trastornos que ocurren cuando un feto se infecta con citomegalovirus durante el embarazo.[1][2][3] Se le conoce también como infección fetal por citomegalovirus,[4] o infección prenatal por citomegalovirus y es la causa más común de infección fetal congénita.[5] La mayoría, alrededor del 90%, no presenta síntomas.[6][7] El citomegalovirus humano (CMV) es un virus de ADN humano específico y ubicuo a nivel mundial que pertenece a la familia Herpesviridae. Fue Goodpasture en 1920[8] quien reconoció las inclusiones en las células infectadas e introdujo el término "citomegalia", utilizado posteriormente por Weller en el nombre del virus, para referirse a su naturaleza agrandada e hinchada.[9]
Cuando una mujer embarazada, positiva para el CMV, transmite el virus en el útero, el CMV puede causar parto prematuro, aborto espontáneo o muerte fetal[10][11][12][13] o graves problemas de salud y/o discapacidades en el feto.[14][15][16] Algunos bebés nacen pequeños para su edad gestacional como consecuencia de la infección.[6] Algunos síntomas pueden incluir erupción cutánea, ojos amarillos, hígado agrandado, inflamación de la retina o convulsiones.[6][17] Las complicaciones a largo plazo se producen en aproximadamente el 20% de los casos: pueden incluir discapacidad visual, una cabeza pequeña y es la causa infecciosa más importante de pérdida de audición neurosensorial y discapacidad intelectual.[6][5]
Esta enfermedad es frecuente en todo el mundo y probablemente no se informe de ella lo suficiente.[18] Las mujeres embarazadas sanas no corren un riesgo particular de contraer enfermedad por infección por CMV. Cuando se infectan con CMV, la mayoría de las mujeres no presentan síntomas y muy pocas padecen una enfermedad similar a la mononucleosis infecciosa. Se calcula que afecta a 1 de cada 200 bebés en Canadá, Estados Unidos y Europa Occidental.[6][7] Las tasas son tres veces superiores en los países de renta baja y media.[18] La muerte se produce en aproximadamente el 1 % de los afectados.[18] La enfermedad se describió claramente por primera vez en la década de 1960,[19] aunque se sospecha que se han producido casos desde la década de 1930.[20] La carga económica parece ser mayor en los países de renta baja y media.[18]
Debido a que muchos niños afectados con CMV requieren cuidados continuos importantes y servicios terapéuticos y educativos especiales, la carga económica asociada con la infección congénita por CMV es sustancial: en los Estados Unidos, el costo anual estimado de la infección congénita por CMV fue de hasta 2 mil millones de dólares en 1992, lo que ha contribuido a la identificación de la necesidad de una vacuna contra el CMV como una prioridad para el siglo XXI.[21]
Remove ads
Etiología
Resumir
Contexto
El CMV es el miembro más grande de la familia de herpesvirus, con un genoma ADN bicatenario de más de 240 kbp, capaz de codificar más de 200 productos proteicos. La función de la mayoría de estas proteínas aún no está clara. Al igual que otros herpesvirus, la partícula viral es una cápside icosaédrica, rodeada por una envoltura externa hecha de una bicapa lipídica.[22] El cCMV se produce cuando una madre se infecta con CMV durante el embarazo y se lo transmite a su feto.[6]
Se sabe poco sobre los mecanismos moleculares responsables de la patogénesis del daño tisular inducido por CMV en la infección congénita. Los mecanismos por los cuales el CMV daña al feto son complejos y probablemente incluyen una combinación de daño celular fetal directo (particularmente a nivel del cerebro fetal) inducido por productos genéticos patológicos codificados por el virus, una respuesta inmune materna incompleta incapaz de controlar completamente la infección durante el embarazo y el impacto de la infección sobre la función placentaria.
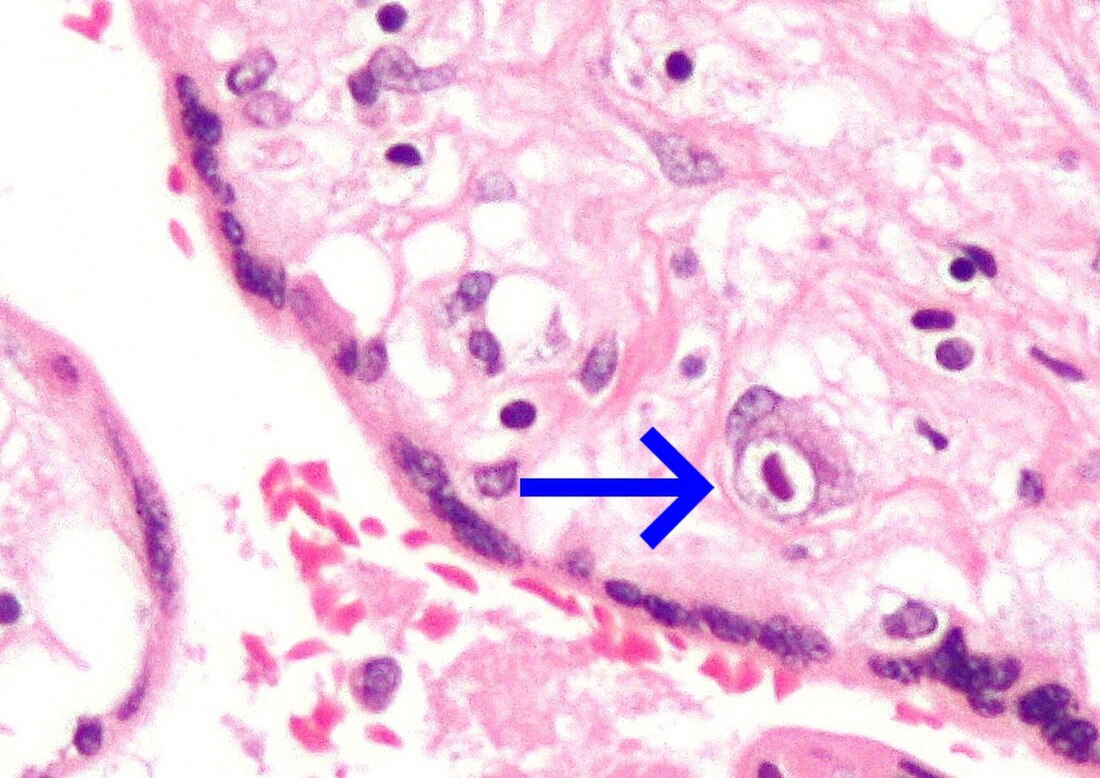
Se presume que la transmisión intrauterina del virus es transplacentaria durante la fase virémica materna. De hecho, la infección placentaria es el primer paso hacia la infección fetal: el hallazgo histopatológico típico de la infección placentaria está representado por vilitis linfoplasmocítica crónica, asociada a necrosis focal y vasculitis.
En la infección por CMV de la mujer embarazada, la placenta desempeñaría tanto una función de reservorio como de barrera protectora.
Remove ads
Epidemiología
Resumir
Contexto
A nivel mundial mundo el CMV congénito varía entre 0,5 y 1% de recién nacidos y en otros países, incluyendo Chile, cuentan con cifras reportadas que van entre 1 y 2% de los recién nacidos.[5] Aproximadamente 1 de cada 3000 bebés que nacen con CMV congénito presentará síntomas y 1 de cada 7000 fallece como consecuencia de complicaciones.[23][24][25] La infección congénita por HCMV ocurre cuando la madre tiene una infección primaria (o reactivación) durante el embarazo. Debido a la menor seroprevalencia del HCMV en los países industrializados y en los grupos socioeconómicos más altos, las infecciones congénitas son en realidad menos comunes en las comunidades más pobres, donde más mujeres en edad fértil ya son seropositivas. En los países industrializados, hasta el 8% de las madres seronegativas al HCMV contraen la infección primaria por HCMV durante el embarazo, de la cual aproximadamente el 50% la transmitirá al feto.[26] Entre el 10 y el 15% de los fetos infectados nacen con síntomas,[27] que pueden incluir neumonía y enfermedades gastrointestinales, retinianas y neurológicas.[28][29] Entre el 85 y el 90% de los recién nacidos infectados son asintomáticos y entre el 10 y el 15% desarrollarán una infección sintomática. En el 10-15% de los fetos infectados que resultan sintomáticos, la mortalidad perinatal es de aproximadamente el 30% y el 70% de los sobrevivientes tendrán secuelas predominantemente neurológicas. Entre el 10 y el 15% de los niños asintomáticos al nacer desarrollarán efectos neurológicos a largo plazo. Incluso considerando aquellos que no están infectados congénitamente y adquieren la infección durante el nacimiento o a través de la leche materna, la infección por CMV ocurre en aproximadamente el 1% de todos los recién nacidos.
El riesgo de la enfermedad grave es mayor cuando la madre se infecta al comienzo de su embarazo y si es su primera infección.[17] El diagnóstico se realiza mediante pruebas en las primeras 3 semanas después del nacimiento, preferiblemente en orina, aunque también se puede utilizar saliva y sangre.[6][17] La posibilidad de infección se reduce lavándose las manos y evitando tocar la saliva o la orina de niños muy pequeños.[6] La infección se produce cuando la madre contrae el CMV durante el embarazo y lo transmite al feto.[6] Tanto la reactivación como la reinfección pueden dar lugar a la enfermedad, y las primeras infecciones tienen un riesgo mayor, de alrededor del 32%.[30] El riesgo es mayor si la madre se infecta en las últimas etapas del embarazo, aunque el riesgo de enfermedad grave es mayor si se infecta al comienzo del embarazo.[17] La mayoría de las mujeres embarazadas infectadas no presentan síntomas, mientras que algunas presentan síntomas similares a los de la mononucleosis.[6][7] El diagnóstico se realiza mediante análisis, preferentemente de orina, aunque también se pueden utilizar los de saliva y sangre, en las primeras 3 semanas después del parto.[17] Los análisis de sangre pueden revelar un aumento de ALT o un nivel bajo de plaquetas.[30]
La pérdida auditiva neurosensorial se encuentra en el 35% de los niños con CMV, se han encontrado déficits cognitivos en el 66% de los niños con CMV y la muerte ocurre en el 4% de los niños.[22] La infección por HCMV ocurre en aproximadamente el 1% de todos los neonatos, y aquellos que no están infectados congénitamente contraen la infección posiblemente a través de la leche materna.[31][32][33] Otras fuentes de infección neonatal son los fluidos corporales que se sabe que contienen altos títulos en individuos que excretan el virus: la saliva (<10 7 copias/ml) y la orina (<10 5 copias/ml)[34][35] parecen ser vías comunes de transmisión.
Las mujeres embarazadas sanas no corren un riesgo especial de contraer enfermedad por infección por CMV. Cuando se infectan con CMV, la mayoría de las mujeres no presentan síntomas y muy pocas padecen una enfermedad parecida a la mononucleosis infecciosa. Son sus fetos en desarrollo los que pueden estar en riesgo de padecer enfermedad congénita por CMV. El CMV sigue siendo la causa más importante de infección viral congénita en los Estados Unidos. El HCMV es la causa más común de infección congénita en humanos y las infecciones primarias intrauterinas son más comunes que otras infecciones y síndromes bien conocidos, incluidos el síndrome de Down, el síndrome de alcoholismo fetal, la espina bífida y el VIH/SIDA pediátrico.[36][23]
Remove ads
Patogenia
Resumir
Contexto
La infección de la mujer embarazada puede ser primaria, si nunca había estado infectada previamente, una reactivación de una infección previa o una reinfección con una cepa viral diferente. El riesgo de transmisión al feto por infección primaria varía entre el 30% y el 40% en el primer y segundo trimestre y entre el 40% y el 70% en el tercer trimestre. El riesgo de transmisión seguida de una infección secundaria es mucho menor (1-2%).[13] La infección congénita por CMV es la infección congénita más común en todo el mundo y en el mundo desarrollado es la principal causa no genética de pérdida de audición neurosensorial (SNHL) en niños.[22][37][38] La infección congénita por CMV también puede provocar secuelas neurológicas graves, como microcefalia, calcificaciones intracraneales, sordera neurosensorial, coriorretinitis, discapacidad motora y cognitiva y epilepsia. Algunos recién nacidos con citomegalovirus congénito pueden presentar signos de infección al nacer, mientras que otros pueden no desarrollar síntomas durante dos o más años. Generalmente, las secuelas del CMVc causadas por una infección primaria en la madre suelen ser más graves que las causadas por la reactivación de una infección latente.
La transmisión de la infección por CMV de madre a feto también puede ocurrir inmediatamente antes, durante o inmediatamente después del parto. La adquisición perinatal de CMV generalmente ocurre después de la exposición a secreciones infectadas en el canal de parto. La transimición postnatal ocurre a través de la lactancia materna.[39] La mayoría de estas infecciones son asintomáticas. En algunos estudios se ha indicado el CMV adquirido a través de la leche materna como una forma de inmunización natural, estudios más recientes no apoyan esta tesis, especialmente en aquellos bebés que nacen prematuros y/o de bajo peso al nacer.[40][41][42]
El papel de la inmunidad materna en la mitigación de la virulencia de la infección fetal/neonatal es controvertido. Algunos estudios han sugerido que la infección congénita transmitida por una infección materna secundaria suele ser asintomática y rara vez conlleva secuelas. Sin embargo, observaciones posteriores han informado de la posibilidad de manifestaciones clínicas graves al nacer y déficits neurológicos permanentes incluso en casos de infección congénita por infección materna recurrente.[23][43][44][45][46]
La infección placentaria probablemente es seguida por una propagación de la infección a las células amnióticas, que son luego absorbidas por el feto. El virus se replica en la orofaringe y posteriormente ingresa al torrente sanguíneo fetal lo que constituye una fase virémica inicial. El CMV se replica posteriormente con un potente efecto dañino en diversos órganos y tejidos, como el sistema nervioso central (SNC), el hígado, el oído interno y el riñón. Se ha atribuido un papel importante para causar daño en los tejidos a la capacidad del virus de infectar y dañar principalmente las células endoteliales de diversos órganos.
El CMV también puede transmitirse durante el parto o el periodo perinatal, ya sea por aspiración de secreciones cervicovaginales en el canal de parto o luego por la lactancia materna.
La transmisión intrauterina, después de una infección materna primaria, ocurre en un promedio del 40% de los casos (el riesgo de transmisión varía del 24 al 75% en varios estudios). Otras fuentes de infección neonatal son los fluidos corporales que se sabe que contienen alto contenido viral: la saliva (<10 7 copias/ml) y la orina (<10 5 copias/ml) parecen ser vías de transmisión comunes. La patogenia de la infección por CMV y el daño al SNC fetal en desarrollo es deficiente debido al número insuficiente de casos en estudios de autopsia y a la especificidad humana del virus, que limita el establecimiento y desarrollo de modelos animales. El tejido embrionario humano puede ser una herramienta eficaz para estudiar el mecanismo de la infección por CMVc en el desarrollo neurológico. En estudios[47][48] de embriones de 21 a 22 semanas se han reportado títulos virales más altos en los órganos que correspondían a respuestas inmunes más graves y daño orgánico. Sugirieron que los defectos de desarrollo del SNC inducidos por la infección por CMVc ocurren principalmente a través de los siguientes mecanismos: en el cerebro, la infección por CMV puede causar directamente respuestas inmunes inapropiadas, y en la placenta, la infección por CMV conduce a disfunción placentaria e hipoxia fetal, que indirectamente perjudican el desarrollo del cerebro.[49]
El CMV puede infectar casi todos los tipos de células, pero tiene un tropismo marcadamente mayor por células madre. Junto con una densidad de células CMV positivas son los dos factores cruciales que determinaron los resultados neuropatológicos en el desarrollo fetal temprano en individuos infectados con CMV.[50] La proteína IE2 codificada por el CMV humano puede regular negativamente la proliferación y la autorrenovación de las células madre neurales reduciendo la cantidad de células madre neurales, lo que lleva a microcefalia en etapas posnatales, y al suprimir la migración de neuronas neonatales, lo que altera la conectividad entre las neuronas.[51]
Los productos del gen del CMV están involucrados en la apoptosis de las células madre neurales y las anomalías producidas por la autofagia, lo que conduce a infecciones del sistema nervioso y trastornos del desarrollo neurológico. Además, la IL-10 puede ser protector del tejido cerebral en contra de daño neurológico debido a la infección por CMV al inhibir la activación neuroinmune inducida por quimiocinas y limitar así el daño cerebral.[52] La pérdida auditiva grave se ha asociado con disfunción vestibular moderada. Se ha informado de la degeneración celular generalizada, fibrosis y calcificación en la cóclea y el sistema vestibular de un paciente de 14 años con secuelas extensas debido a la infección por CMVc.[53] Esto sugiere que los efectos citopáticos virales durante el desarrollo del sistema auditivo conducen a daño celular irreparable y disfunción vestibular, que pueden constituir el mecanismo de pérdida auditiva causada por la infección por CMVc.
Remove ads
Cuadro clínico
Resumir
Contexto
Al nacer, entre el 85 y el 90% de los neonatos infectados son asintomáticos y entre el 10 y el 15% tienen una infección clínica aparente.[23][54] En el caso de bebés infectados por sus madres antes del nacimiento, existen dos posibles escenarios adversos:
- Puede ocurrir una infección generalizada en el bebé y causar complicaciones como bajo peso al nacer, microcefalia, convulsiones, erupción petequial similar a la erupción en "muffin de arándanos" del síndrome de rubéola congénita y hepatoesplenomegalia moderada (con ictericia). Aunque los casos graves pueden ser fatales, con tratamiento de apoyo la mayoría de los bebés con enfermedad por CMV sobrevivirán. Sin embargo, entre el 80% y el 90% tendrán complicaciones durante los primeros años de vida que pueden incluir pérdida de audición, problemas de visión y diversos grados de discapacidad de aprendizaje.
- Entre el 5% y el 10% de los bebés infectados pero que no presentan síntomas al nacer presentarán posteriormente diversos grados de problemas auditivos, mentales o de coordinación. El CMV es la causa más común de pérdida auditiva neurosensorial no genética en niños. La aparición de la pérdida auditiva puede ocurrir en cualquier momento durante la infancia, aunque comúnmente ocurre durante la primera década. Es progresiva y puede afectar ambos oídos. Cuanto antes contraiga la madre el virus durante el embarazo, más graves serán los efectos sobre el feto; de manera similar, la incidencia de pérdida auditiva neurosensorial depende del trimestre del embarazo en el que se contraiga el CMV. El virus es responsable del 20% de los casos de pérdida auditiva neurosensorial en niños.[55][22]
Estos riesgos parecen estar asociados casi exclusivamente a mujeres que no han sido infectadas previamente con CMV y tuvieron su primera infección con el virus durante el embarazo. Parece haber poco riesgo de complicaciones relacionadas con el CMV en mujeres que han sido infectadas al menos 6 meses antes de la concepción. En este grupo, que representa entre el 50% y el 80% de las mujeres en edad fértil, la tasa de infección por CMV en recién nacidos es del 1%, cuyos bebés no suelen presentar síntomas o anomalías significativas.[56]
El virus también puede transmitirse al bebé durante el parto a través del contacto con secreciones del canal del parto o en la infancia a través de la leche materna.[84] Sin embargo, suelen ser infecciones que generalmente provocan poca o ningún cuadro clínico en el bebé. El CMV también puede transmitirse a través de transfusiones de sangre y el contacto cercano con grandes grupos de niños.[85]
Durante un embarazo cuando una mujer que nunca ha tenido una infección por CMV se infecta con CMV, existe el riesgo de que después del nacimiento el bebé pueda tener complicaciones relacionadas con el CMV, las más comunes de las cuales están asociadas con pérdida de audición, discapacidad visual o disminución de las capacidades mentales y motoras. Por otro lado, los bebés y niños sanos que adquieren el CMV después del nacimiento tienen pocos o ningún síntoma o complicación. Los bebés nacidos prematuramente e infectados con CMV después del nacimiento (especialmente a través de la leche materna[86]) pueden experimentar deterioro cognitivo y motor más adelante en la vida.[87][88]
Los síntomas asociados con el CMV neonatal, como la pérdida de audición, pueden provocar un mayor retraso en el desarrollo del bebé. Un retraso en el desarrollo general del habla y del lenguaje es muy común en niños con CMV congénito.[89] Se ha descubierto que los niños con CMV sintomático tienen una mayor incidencia de complicaciones neurológicas y del desarrollo neurológico a largo plazo que los niños con síndrome de alcoholismo fetal o síndrome de Down.[85]
La infección congénita por citomegalovirus puede ser una causa importante de hemorragia intraventricular y encefalopatía neonatal.[72] La identificación prenatal del CMV es efectiva para planificar medidas terapéuticas y también para brindar atención oportuna e informar a la familia sobre los riesgos potenciales de una infección congénita por CMV.
| Anomalías extracerebrales: intestino hiperecogénico de grado 2 o 3; oligo polihidramnios; restricción del crecimiento fetal[61] ascitis y/o derrame pleural; edema de la piel; hidropesía fetal; placentomegalia >40mm; hepatomegalia; esplenomegalia; calcificaciones del hígado |
| Diagnóstico por ecografía Doppler de la arteria cerebral media de anemia fetal; y/o una anomalía cerebral aislada entre: ventriculomegalia moderada aislada <15 mm; calcificación cerebral aislada; sinequia intraventricular aislada; vasculopatía de los vasos lenticuloestriados |
| Resultados de laboratorio de sangre fetal sugestivos de infección por CMV: viremia fetal >3000 copias/ml o recuento de plaquetas <100.000/mm3. |
Pérdida auditiva
Entre los bebés que desarrollan pérdida auditiva neurosensorial relacionada con el CMV congenita, esta puede estar presente al nacer o puede aparecer tardíamente. La pérdida auditiva neurosensorial de aparición tardía ocurre durante los primeros años de vida, con una edad media de aparición de 33 meses para los niños sintomáticos y de 44 meses para niños asintomáticos. Aproximadamente 50% de los niños con pérdida auditiva neurosensorial sufren un mayor deterioro o progresión de la pérdida durante la infancia. El grado de pérdida auditiva puede variar en hasta la mitad de los recién nacidos. Por lo tanto, es importante que todos los niños con infección congénita por CMV, independientemente de su presentación clínica al nacer, reciban un seguimiento audiológico seriado durante los primeros años de vida. La identificación temprana y las intervenciones no farmacológicas pueden reducir el deterioro funcional resultante de la pérdida auditiva, mejorando significativamente el lenguaje receptivo y expresivo, y también el desarrollo socioemocional del niño afectado.[91]
En general, casi el 50% de los niños sintomáticos y el 10% de los niños asintomáticos desarrollan algún grado de pérdida auditiva, lo que hace que la infección congénita por CMV sea la principal causa no genética de pérdida auditiva neurosensorial en niños.[73] Se estima que casi el 25% de la pérdida auditiva en niños de 4 años es atribuible al CMV congénito.[92] Actualmente, se desconocen los predictores de resultados adversos en la infección congénita asintomática por CMV.[61] También se ha informado con frecuencia el deterioro vestibular, que igualmente puede mostrar un deterioro progresivo con el tiempo.[93] Además, el CMV congénito es la principal causa viral de retraso del desarrollo neurológico; una gran proporción de bebés sintomáticos sufren algún grado de discapacidad psicomotora y cognitiva, y más de la mitad de los bebés sintomáticos presentan discapacidad visual.[25][94]
Discapacidad intelectual
Entre un 5 y un 10% de los niños infectados que no presentan síntomas al nacer tendrán más adelante diversos problemas auditivos, mentales o de coordinación. Estudios preliminares han demostrado que la infección por CMVc afecta el desarrollo mental de los niños, lo que tiene un impacto dramático en sus comportamientos y manifestaciones a largo plazo.[54][95][96][97][98]
Estudios posteriores han encontrado evidencia sólida de retraso mental (CI < 70) causado por la infección por CMVc.[99] Cuanto antes contraiga la madre el virus durante el embarazo, más graves serán los efectos sobre el feto; de manera similar, la incidencia de pérdida auditiva neurosensorial depende del trimestre del embarazo en el que se contraiga el CMV.[95] El virus es responsable del 20% de los casos de pérdida auditiva neurosensorial en niños.
Los niños que nacen prematuros y se infectan con CMV después del nacimiento, principalmente a través de la leche materna, pueden presentar discapacidades cognitivas y motoras más adelante en la vida.[100] Los síntomas asociados con el CMV, como la pérdida de audición, pueden causar un mayor retraso en el desarrollo. Un retraso en el desarrollo general del habla y del lenguaje es más común en niños con CMV. Se ha descubierto que los niños con CMV sintomático tienen una mayor incidencia de complicaciones neurológicas y del desarrollo neurológico a largo plazo que los niños con síndrome de alcoholismo fetal o síndrome de Down. La infección congénita por citomegalovirus puede ser una causa importante de hemorragia intraventricular y encefalopatía.
El CMVc está además involucrado en la aparición de autismo. En particular la infección por CMV durante el tercer trimestre de gestación puede aumentar el riesgo de autismo.[101][102][103][104]
Remove ads
Diagnóstico
Resumir
Contexto
A pesar de la carga sanitaria, social y económica que supone, la infección congénita por CMV a menudo no se detecta al nacer porque la mayoría de los bebés afectados son asintomáticos o tienen síntomas que son lo suficientemente inespecíficos como para que los médicos sospechen la infección. En muchos países no se han desarrollado ni implementado programas de detección, ni en mujeres embarazadas ni en recién nacidos.[105][26] En los últimos años, uno de los obstáculos para la implementación de un programa de detección neonatal ha sido la falta de una prueba de detección adecuada que constituya un análisis de alto rendimiento.[75] Los Centros para el Control y la Prevención de Enfermedades (CDC) estadounidense no recomiendan la detección sistemática de la infección por CMV en las madres durante el embarazo porque:[106] El diagnóstico de CMVc en recién nacidos sólo se puede realizar si el virus se detecta durante la primera semana de vida.
- la mayoría de las pruebas de laboratorio disponibles pueden ser difíciles de interpretar,
- las pruebas actuales no pueden predecir si el feto podría estar infectado o lesionado por la infección,
- la falta de un tratamiento comprobado para prevenir o eliminar la infección fetal reduce los posibles beneficios de una detección prenatal,
- no existe ninguna prueba que pueda descartar definitivamente la infección primaria por CMV durante el embarazo.
Las mujeres que estén preocupadas por la infección por CMV durante el embarazo deben practicar medidas de prevención. Teniendo en cuenta que el virus CMV está presente en la saliva, la orina, las lágrimas, la sangre, la mucosidad y otros fluidos corporales, es importante lavarse las manos con frecuencia con agua y jabón después del contacto con pañales o secreciones orales.
Los hallazgos de laboratorio y de imágenes incluyen: trombocitopenia, transaminasas elevadas, hiperbilirrubinemia directa, coriorretinitis, anomalías en las neuroimágenes indicativas de afectación del sistema nervioso central (SNC) y pérdida auditiva neurosensorial.[13][61] Sin embargo, los criterios diagnósticos de la infección sintomática varían ampliamente en la literatura. Por ejemplo, algunas series de casos consideran que los sujetos con anomalías detectadas mediante pruebas específicas, incluida la hipoacusia neurosensorial, son asintomáticos, mientras que otros casos no.[107] Algunos estudios han clasificado a los bebés aislados con bajo peso al nacer como casos sintomáticos, mientras que otros estudios no.[73] Estas diferencias pueden explicar parte de la variabilidad en la prevalencia de la infección sintomática y la gravedad de la enfermedad entre estudios.
Inmunidad
Las personas infectadas con CMV desarrollan anticuerpos contra el virus, inicialmente IgM y luego IgG,[14] lo que indica infección actual e inmunidad persistente respectivamente. La prueba materna para inmunoglobulina M (IgM) contra CMV es la prueba más comúnmente utilizada para detectar la infección materna primaria. La IgM también puede ser positiva en caso de reinfección o reactivación del virus. La IgM contra CMV alcanza su punto máximo en los primeros 1 a 3 meses y puede persistir hasta 12 meses. Además, no es infecuente que se obtengan resultados falsos positivos de IgM en presencia de alguna otra enfermedad autoinmune o infección por otro virus. Debido a las dificultades asociadas con la interpretación de los resultados de IgM, la avidez de la inmunoglobulina G (IgG) sérica puede ser una prueba útil para distinguir entre la infección materna primaria y la reinfección o reactivación. La IgG sérica detectada hasta 18 semanas después de la infección materna primaria tiene una avidez baja a moderada, mientras que la IgG de alta avidez puede persistir durante años.[108] Cuando se interpretan en conjunto, la baja avidez de IgG materna y la IgM detectable en la sangre de la madre pueden ser fuertes indicadores de una infección materna primaria positiva.[108][109]
Prueba de CMV
Se puede realizar el diagnóstico de infección congénita por CMV si se encuentra el virus en la orina, la saliva, la sangre u otros tejidos corporales de un bebé durante la primera semana después de su nacimiento. Las pruebas de anticuerpos no se pueden utilizar para obtener el diagnosticar el CMV congénito; el diagnóstico sólo se puede realizar si el virus se detecta durante la primera semana de vida. El aislamiento del virus de la orina o la saliva en cultivos de tejidos ha sido el método estándar para el diagnóstico de la infección congénita por CMV. Esta técnica es laboriosa y requiere recursos elevados, involucra el cultivo de tejidos afectados y, por lo tanto, no es adecuada para fines de detección generalizada. La optimización de la tecnología de reacción en cadena de la polimerasa (PCR) ha dado lugar a importantes avances en las capacidades de diagnóstico, ya que es susceptible de automatización, tiene bajo coste y es poco probable que se vea afectada por las condiciones de almacenamiento y transporte de las muestras.[110][22]
A los bebés visualmente sanos no se les realizan pruebas de detección de infección por CMV de forma rutinaria. Hasta el 80% puede mostrar signos de infección prenatal en etapas posteriores de la vida. Si una mujer embarazada descubre que se ha infectado con CMV por primera vez durante su embarazo, debe hacerle una prueba de CMV a su bebé lo antes posible después del nacimiento.[cita requerida]
El tratamiento para la infección por CMV debe comenzar al mes de edad y debe durar 6 meses. Las opciones de tratamiento son madicamentos que incluyen ganciclovir intravenoso y valganciclovir por vía oral. Después del diagnóstico, es importante investigar más a fondo cualquier posible evidencia de enfermedad de órganos diana y síntomas a través de análisis de sangre, imágenes, pruebas oftalmológicas y pruebas de audición.[27]
Diagnóstico fetal
La amniocentesis para la detección del ADN del CMV es la herramienta más eficaz en el diagnóstico prenatal de la infección congénita por CMV. La amniocentesis diagnóstica debe realizarse idealmente después de las 21 semanas de gestación y 6 semanas después de la infección materna primaria. Existe un riesgo conocido de un resultado falso negativo si la amniocentesis se realiza antes de la semana 21 de gestación.[108][109] La identificación del CMV en recién nacidos es crucial para iniciar medidas de atención y manejo oportunas.[65]
PCR
Se ha planteado la hipótesis de que las gotas de sangre seca (GSS) sean una muestra de detección práctica para la infección congénita por CMV. En general, la sensibilidad de la PCR realizada en GSS varió del 28,3 % utilizando un ensayo de cebador único al 34,4 % utilizando un ensayo de cebador doble. La especificidad de ambos protocolos de PCR fue del 99,9%. Otros estudios han informado de una sensibilidad variablemente mayor de detección de ADN de CMV por PCR en muesrtas de GSS, hasta el 100%, pero todos fueron estudios retrospectivos o estudios prospectivos de poblaciones seleccionadas con infección por CMV.[111][112] Las razones de esta gran variabilidad en la sensibilidad podrían estar relacionadas con problemas técnicos (método de extracción de ADN, protocolo de PCR, cantidad de material moteado), pero también podrían deberse al hecho de que no todos los niños con infección congénita por CMV, ya sean sintomáticos o asintomáticos, tienen viremia detectable al nacer.[110][113]
En la actualidad y con los métodos disponibles, la prueba de CMV con PCR en tiempo real en muestras de GSS no es adecuada para fines de detección de CMV[114] y su principal utilidad sigue siendo el diagnóstico retrospectivo de la infección congénita por CMV en niños que presentan secuelas de aparición tardía. Un resultado positivo confirma la infección congénita por CMV, pero un resultado negativo no la excluye.[115]
A diferencia de las muestras de GSS, el análisis de PCR en tiempo real en hisopos de saliva produjo excelentes resultados, tanto para hisopos secados al aire como para hisopos enviados al laboratorio en medio de transporte viral. La sensibilidad y especificidad reportadas de la prueba de PCR en saliva líquida (aquellas enviadas en medios de transporte viral) fueron del 100% y 99,9%, respectivamente. Para la prueba de PCR con saliva seca, la sensibilidad y especificidad fueron del 97,4% y 99,9%, respectivamente. La tasa de falsos positivos fue inferior al 0,03%. Por lo tanto, la prueba de PCR de saliva para evaluar a los recién nacidos positivo debe confirmarse dentro de las primeras 3 semanas de edad para evitar resultados de detección con falsos positivos.[116] La excelente sensibilidad analítica y la facilidad de recolección de saliva de los recién nacidos hacen que esta muestra sea ventajosa en la detección del CMV en recién nacidos.[110]
Investigación por imágenes
Los hallazgos con ecografía cerebral, la resonancia magnética o la tomografía computarizada observados en neonatos con infección congénita por CMV incluyen:[117][118][119]
- Las calcificaciones cerebrales son el hallazgo más frecuente. Se localizan mayoritariamente en la zona subependimaria y a nivel de los ganglios basales. Las calcificaciones pueden asociarse con imágenes en candelabro a nivel talámico y signo de vasculitis de los vasos lenticuloestriatales.
- Radiolucidez periventricular en la tomografía, hiperecogenicidad periventricular en la ecografía.
- Ventriculomegalia, debida a obstrucción de los agujeros de Luska y Magendie.
- Quistes cerebrales.
- Trastornos de la migración neuronal (paquigiria, lisencefalia, displasia cortical) y parecen deberse a la acción teratogénica del virus.
A la luz de los conocimientos de la embriología, analizando las imágenes neurorradiográficas de recién nacidos con infección congénita por CMV adquirida en diferentes edades gestacionales, se ha sugerido que la presencia de lisencefalia está relacionada con un daño ocurrido antes de la semana 16-18 de gestación, mientras que la polimicrogiria es compatible con un daño ocurrido entre la semana 18 y 24.[72]
Diagnóstico diferencial
En el recién nacido con CMVc, el diagnóstico diferencial incluye cualquiera de los agentes de infecciones de transmisión vertical que conducen a anomalías congénitas. Entre ellas se encuentran la toxoplasmosis, rubeola, herpes simple y la sífilis.
La toxoplasmosis congénita puede imitar una infección congénita por CMV. Es poco común en los Estados Unidos. Sin embargo, en algunas partes de Europa, especialmente Francia y Bélgica, la toxoplasmosis congénita es un problema común y significativo. A diferencia del CMV congénito, las calcificaciones intracraneales observadas en la toxoplasmosis congénita tienden a ser difusas en todo el cerebro y no en la distribución periventricular clásica del CMV, lo que puede ser una pista importante para su diferenciación.
Remove ads
Tratamiento
Resumir
Contexto
En caso de infección fetal confirmada, se debe informar a los padres sobre los riesgos establecidos de infección sintomática y morbilidad a largo plazo después de la infección intrauterina por CMV, a fin de orientar la toma de decisiones con respecto a la interrupción del embarazo o las opciones de manejo del embarazo.[120] Las terapias intrauterinas siguen siendo experimentales.[36]
Hasta la fecha, no existen tratamientos prenatales eficaces y seguros para prevenir la transmisión del virus de la madre a su hijo. El tratamiento de las infecciones congénitas sintomáticas por CMV con medicamentos antivirales (ganciclovir o valganciclovir), iniciado en el primer mes de vida y bajo la supervisión de un pediatra, puede reducir los daños a largo plazo, en particular el deterioro de la función auditiva y psicomotora en los niños infectados. El valganciclovir puede tener efectos secundarios graves.[13]
Los avances en la terapia antiviral neonatal para bebés sintomáticos han sido sustanciales. Los estudios que evalúan el tratamiento de la infección congénita por CMV comenzaron hace 30 años, con el ganciclovir intravenoso (GCV, que es un análogo acíclico de la desoxiguanosina), posteriormente reemplazado por el valganciclovir oral (VGCV, un éster L-valina de aciclovir) como fármaco de primera línea.[14][121]
El tratamiento del CMVc generalmente se inicia sólo en bebés con cuadros moderados a grave. El tratamiento generalmente se inicia solo durante el primer mes de vida y hasta la fecha no hay evidencia que respalde el tratamiento después de este período. Los bebés y niños de 4 meses a 4 años pueden ser cadidatos para recibir tratamiento como parte de estudios de investigación. El valganciclovir oral debe iniciarse en lactantes alimentados por vía enteral a una dosis de 16 mg/kg dos veces al día.
Los datos sobre el uso de agentes antivirales para la profilaxis y el tratamiento del CMVc son limitados. Administrar terapia anti-CMV sólo después de consultar a un experto familiarizado con las dosis y los efectos adversos. Los agentes antivirales pueden administrarse de forma terapéutica para la enfermedad por CMV establecida o de forma preventiva cuando el riesgo de desarrollar la enfermedad por CMV es alto.
Tratamientos prenatales
El tratamiento con globulina hiperinmune en madres con infección primaria por CMV ha demostrado ser eficaz en la prevención de enfermedades congénitas.[122][123][124][125] Un estudio no mostró una disminución significativa del riesgo de infección congénita por citomegalovirus con el uso prenatal de globulina hiperinmune.[126] Otra opción de tratamiento prenatal fuera de etiqueta es la administración oral de valaciclovir a mujeres embarazadas con fetos infectados por CMV moderadamente sintomáticos.[90] Un estudio no aleatorizado y no controlado[27] demostró un mejor resultado en neonatos de mujeres tratadas con valaciclovir en dosis altas (82% neonatos asintomáticos con infección por CMV) en comparación con el grupo de control histórico no tratado (43% de neonatos infectados asintomáticos).[127] Las mujeres embarazadas con fetos infectados por CMV gravemente sintomáticos fueron excluidas del estudio, lo que dificulta la interpretación de estos resultados. Los eventos adversos notificados incluyen dolor de cabeza transitorio (2/41; 4,81%) y un aumento clínicamente irrelevante (< 40 UI/L) en los niveles de AST y ALT. Otros estudios han confirmado que la administración de altas dosis de valaciclovir a mujeres embarazadas infectadas reduciría el riesgo de transmisión vertical.[127] Ambos tratamientos prenatales (antivirales e inmunoglobulinas), aunque ya están incluidos en algunos ensayos clínicos, a fecha de 2021 no han pasado todos los controles necesarios e implican el uso off-label de medicamentos con un consentimiento informado específico.
Interrupción del embarazo
En los países donde la interrupción del embarazo está regulada legalmente, se le podrá informar a la embarazada sobre la posibilidad del aborto, después de haber sido informada de los porcentajes de riesgo de infección y los tipos de daños y secuelas relacionadas con el CMVc para el feto.[128][129][130][131]
La interrupción del embarazo generalmente se discute después de que han surgido signos diagnósticos que sugieren un alto riesgo de daño relacionado con el CMVc para el bebé. Incluso en ausencia de certeza de daño significativo y actual para el feto para el momento del diagnóstico materno, por ejemplo, después de aparecer evidencias de una infección primaria en el primer trimestre o después de una amniocentesis o cordocentesis positiva para CMV o de hallazgos ecográficos o de resonancia magnética que muestren anomalías relacionadas con el CMVc.[128][129][132] Las anomalías graves en la ecografía cerebral se asocian a un mal pronóstico. Es difícil de establecer el pronóstico de un feto infectado que no muestra características ecográficas o anomalías ecográficas no graves hasta el final del segundo o tercer trimestre del embarazo.[133]
Remove ads
Prevención
Resumir
Contexto
Algunas recomendaciones que se han compartido con mujeres embarazadas ante la infección por CMV:[cita requerida]
- Durante todo el embarazo, las estrategias de una buena higiene personal, especialmente lavarse las manos con agua y jabón después del contacto con pañales o secreciones orales (en particular si el niño está en una guardería) conducen a reducciones del riesgo de contagio. Se debe evitar compartir alimentos, utensilios para comer y beber y el contacto con la saliva de los niños pequeños.
- Las mujeres que desarrollan una enfermedad similar a la mononucleosis durante el embarazo deben ser evaluadas para detectar una infección por CMV y recibir asesoramiento sobre los posibles riesgos para el feto.
- Se pueden realizar pruebas de laboratorio para detectar anticuerpos contra el CMV para determinar si una mujer ya ha tenido una infección por CMV.
- La recuperación de CMV del cuello uterino o de la orina de la mujer en el momento del parto o antes no justifica una cesárea.
- Los beneficios demostrados de la lactancia materna superan el riesgo mínimo de contraer CMV de la madre lactante.
- No es necesario realizar pruebas de detección del CMV ni excluir de las escuelas o instituciones a los niños que lo excretan porque el virus se encuentra con frecuencia en muchos niños y adultos sanos.
Se ha demostrado que el tratamiento con globulina hiperinmune en madres con infección primaria por CMV es eficaz para prevenir la enfermedad congénita.[134][135][136][137] Un estudio no mostró una disminución significativa del riesgo de infección congénita por citomegalovirus en mujeres con inmunoglobulina.[126]
Se recomienda realizar pruebas rutinarias de audición y visión a los niños afectados.[138]
Cuidado de niños
La mayoría de las personas sanas que trabajan con bebés y niños no enfrentan ningún riesgo especial de infección por CMV. Sin embargo, para las mujeres en edad fértil que no hayan sido infectadas previamente con CMV, existe un riesgo potencial para el feto en desarrollo. El contacto con niños que asisten a guarderías, donde la infección por CMV se transmite comúnmente entre niños pequeños (en particular, los bebés) puede ser una fuente de exposición al CMV. Dado que el CMV se transmite a través del contacto con fluidos corporales infectados, incluida la orina y la saliva, los proveedores de cuidado infantil (es decir, trabajadores de guarderías, maestros de educación especial y madres) deben recibir educación sobre los riesgos de la infección por CMV y las precauciones que pueden tomar.[139]
Algunas recomendaciones para personas que cuidan a bebés y niños incluyen:
- Se debe educar a los empleados sobre el CMV, su transmisión y las prácticas higiénicas, como el lavado de manos, que minimizan el riesgo de infección.[cita requerida]
- Las mujeres no embarazadas susceptibles que trabajan con bebés y niños no deben ser transferidas rutinariamente a otras situaciones laborales.[cita requerida]
- Las mujeres embarazadas que trabajan con bebés y niños deben ser informadas del riesgo de contraer una infección por CMV y de los posibles efectos sobre el feto.[cita requerida]
- No se recomienda específicamente realizar pruebas de laboratorio de rutina para detectar anticuerpos contra el CMV en trabajadoras debido a su alta incidencia, pero se pueden realizar para determinar su estado inmunológico.[cita requerida]
Remove ads
Referencias
Enlaces externos
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads