Top Qs
Línea de tiempo
Chat
Contexto
Sulfuro ácido de sodio
compuesto químico De Wikipedia, la enciclopedia libre
Remove ads
El sulfuro ácido de sodio (en la nomenclatura clásica bisulfuro de sodio o bisulfuro sódico y ocasionalmente, en traducciones directas del inglés, hidrogenosulfuro de sodio) es un compuesto químico con fórmula NaHS. Este compuesto es el producto de la semineutralización del sulfuro de hidrógeno (H
2S ) con hidróxido de sodio (NaOH). El sulfuro ácido de sodio es un sólido cristalino, higroscópico, incoloro o ligeramente amarillo con cierto olor a putrefacto debido a la presencia de pequeñas cantidades de sulfuro de hidrógeno provenientes de la hidrólisis producida por la humedad atmosférica. El NaHS y el sulfuro de sodio, (Na2S) tienen similares usos industriales.
Remove ads
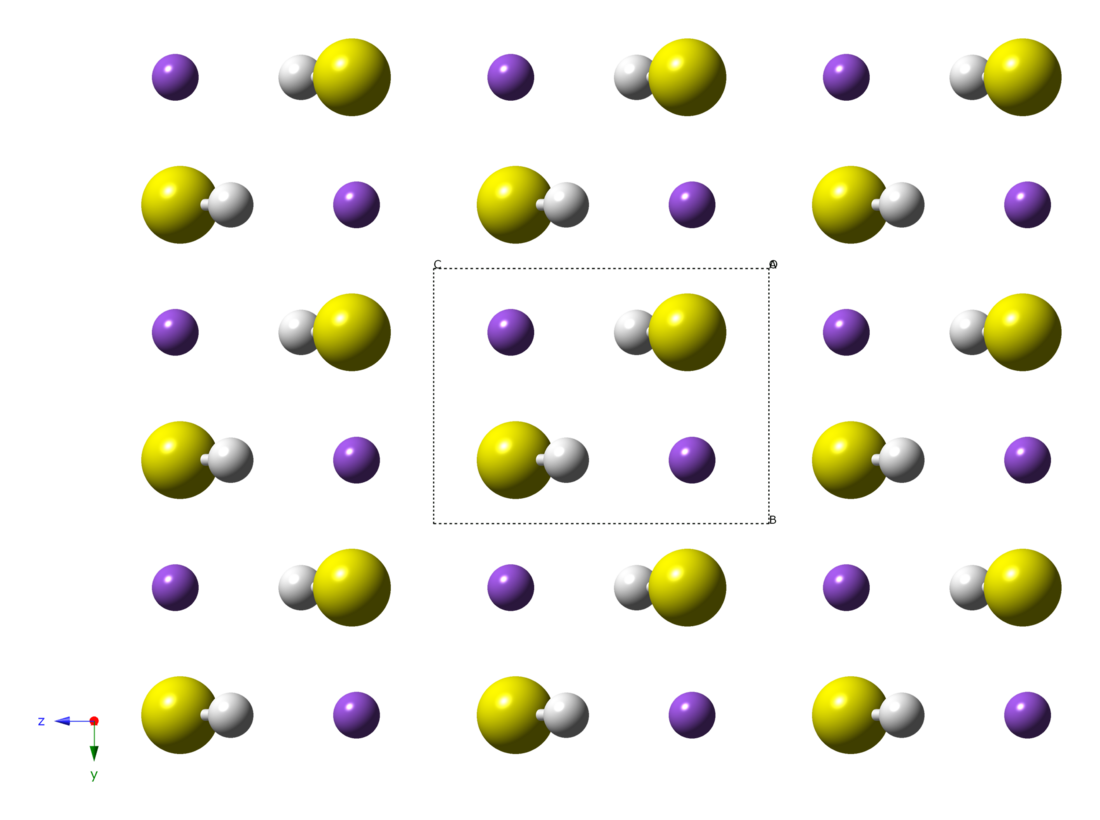
Estructura y propiedades
El NaHS cristalino anhidro experimenta dos transiciones de fase. A temperaturas superiores a 360 K, NaSH adopta la estructura NaCl. Por debajo de 360 K, se forma una estructura romboédrica. Por debajo de 114 K, la estructura se vuelve monoclínica. Los compuestos análogos de rubidio y potasio se comportan de manera similar.[2]
El NaSH tiene un punto de fusión relativamente bajo, de 350 °C. Además de las formas anhidras mencionadas anteriormente, se puede obtener en forma hidratada, con dos y tres moléculas de agua, NaSH·2H2O y NaSH·3H2O. Estas tres especies son incoloras y se comportan de manera similar, pero no idéntica. Puede utilizarse para precipitar otros bisulfuros metálicos, mediante tratamiento de soluciones acuosas de sus sales con sulfuro ácido de sodio. Al tratarse de una sal semineutralizada de un ácido diprótico, tiene propiedades anfóteras, pudiendo reaccionar con ácidos o con bases fuertes. En disolución acuosa, se muestra preferentemente como base, por lo que sus disoluciones presentan pH próximo a 10 y un característico olor a putrefacto, debido a la formación de sulfuro de hidrógeno, H2S.
Remove ads
Preparación
En el laboratorio dse puede preparar mediante tratamiento de etóxido de sodio (NaOEt) con sulfuro de hidrógeno: [3]
Un método alternativo implica la reacción del sodio con sulfuro de hidrógeno.[4]
Remove ads
Aplicaciones
Se producen miles de toneladas de NaHS anualmente. Sus principales aplicaciones industriales están relacionadas con la fabricación de telas y papel, como químico reconstituyente del azufre utilizado en el proceso kraft, como agente de flotación en la minería del cobre, donde se utiliza para activar especies minerales de óxido, y en la industria del cuero utilizándose en el proceso de curtido para la eliminación del pelo y la epidermis de las pieles.[5]
En la industria textil, el bisulfuro de sodio se emplea en la eliminación de tinte de las fibras textiles durante procesos de teñido y estampado.
En el tratamiento de aguas residuales puede emplearse para la reducción de metales pesados y para el tratamiento de compuestos sulfurados en aguas residuales industriales.[6]
También se utiliza en la industria del vidrio, en la fabricación de vidrios fotocrómicos, que cambian de color en respuesta a la luz ultravioleta.[6]
Véase también
Referencias
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads