Top Qs
Chronologie
Chat
Contexte
Acide conjugué
De Wikipédia, l'encyclopédie libre
Remove ads
En chimie, l'acide conjugué d'une base est l'espèce chimique (ion ou molécule) qui forme avec cette base un couple acide/base.
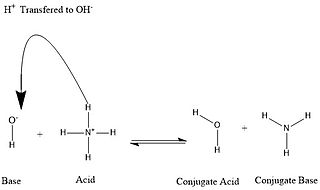
L'acide conjugué d'une base forte est un acide très faible ou nul (les couples hydroxyde/eau, hydrure/hydrogène et amidure/ammoniac par exemple).
L'acide conjugué d'une base très faible ou nulle est un acide fort (les couples chlorure/acide chlorhydrique, bromure/acide bromhydrique et iodure/acide iodhydrique par exemple).
Pour les cas intermédiaires, plus la base est forte, plus l'acide conjugué est faible et inversement.
Une espèce chimique à la fois acide conjugué d'un couple et base conjuguée d'un autre est amphotère (c'est un ampholyte) : elle peut réagir comme un acide en milieu basique, ou comme une base en milieu acide.
Remove ads
Demi-équation Acide/base
Le couple Acide/Base est de la forme :
- AH / A−
La demi-équation Acide/Base correspondante est :
- AH A− + H+
Réaction de dissolution
Lors de la dissolution d'un acide dans l'eau, les protons sont solvatés par les molécules d'eau.
L'acide AH du couple AH/A− réagit avec l'eau, base du couple H3O+/H2O.
Les demi-équations acide/base sont :
- AH A− + H+
- H2O(l) + H+ H3O+(aq)
La réaction de dissolution d'un acide s'écrit donc :
- AH + H2O(l) A−(aq) + H3O+(aq)
Remove ads
Liens externes
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads

