A kén oxosavai kénből, oxigénből és hidrogénből álló kémiai vegyületek. Közülük a legismertebb és ipari szempontból messze a legfontosabb a kénsav. A kénnek ugyanakkor számos más oxosava is létezik, bár ezek egy része csak só formájában ismert (a lenti táblázatban ezek dőlt betűvel vannak jelölve). A jellemzett savak változatos szerkezeti elemeket tartalmaznak, például:
- oxigénatomokhoz koordinálódó tetraéderes kénatom
- terminális és hídkötésben lévő oxigénatomok
- terminális és hídkötésben lévő peroxo-csoport
- terminális S=S
- (-S-)n láncok
További információk Sav, 'Képlet ...
| Sav |
'Képlet |
S oxidációs állapota |
Szerkezet |
Savmaradék anion |
Megjegyzés |
| Kénsav |
H2SO4 |
VI |
 |
Szulfát (SO2−4) és hidrogén-szulfát (HSO−4) vagy régiesen biszulfát |
A kén legismertebb és iparilag legjelentősebb oxosava. |
| Dikénsav (pirokénsav) |
H2S2O7 |
VI |
 |
Diszulfát (S2O2−7) vagy régiesen piroszulfát |
Tiszta állapotban olvadáspontja 36 °C. Megtalálható a füstölgő kénsavban (óleum). |
| Peroxo-monokénsav |
H2SO5 |
VI |
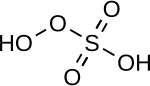 |
Peroxo-monoszulfát, OOSO2−3 |
„Caro-sav”, 45 °C-on olvadó szilárd anyag. |
| Peroxo-dikénsav |
H2S2O8 |
VI |
 |
Peroxo-diszulfát, O3SOOSO2−3 |
Szilárd anyag, olvadáspontja 65 °C. |
| Ditionsav |
H2S2O6 |
V |
 |
Ditionát (O3SSO2−3) |
Tiszta állapotban nem ismert, tömény oldata előállítható. |
| Tiokénsav |
H2S2O3 |
IV |
 |
Tioszulfát (S2O2−3)
Hidrogéntioszulfát (HS2O2−3) (ammóniumsóját előállították vízmentes metanolban −80 °C-on[1]) |
Vizes oldata bomlik. |
| Dikénessav |
H2S2O5 |
IV |
 |
Diszulfit (S2O2−5) |
Tiszta állapotban nem ismert. |
| Kénessav |
H2SO3 |
IV |
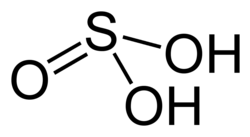 |
Hidrogén-szulfit (HSO−3) és szulfit (SO2−3) |
Tiszta állapotban nem ismert. |
| Ditionossav |
H2S2O4 |
III |
 |
Ditionit, O2SSO2−2 |
Tiszta állapotban nem ismert. |
| Politionsav |
H2SxO6 |
|
 |
Politionát, O3S(Sx-2)SO2−3, például tetrationát. |
Ismertek az x= 3, 4, 5, 6, 7, 8, 10, 12, 14 vegyületek. |
Bezárás










