Timeline
Chat
Prospettiva
Particella α
radiazione corpuscolare Da Wikipedia, l'enciclopedia libera
Remove ads
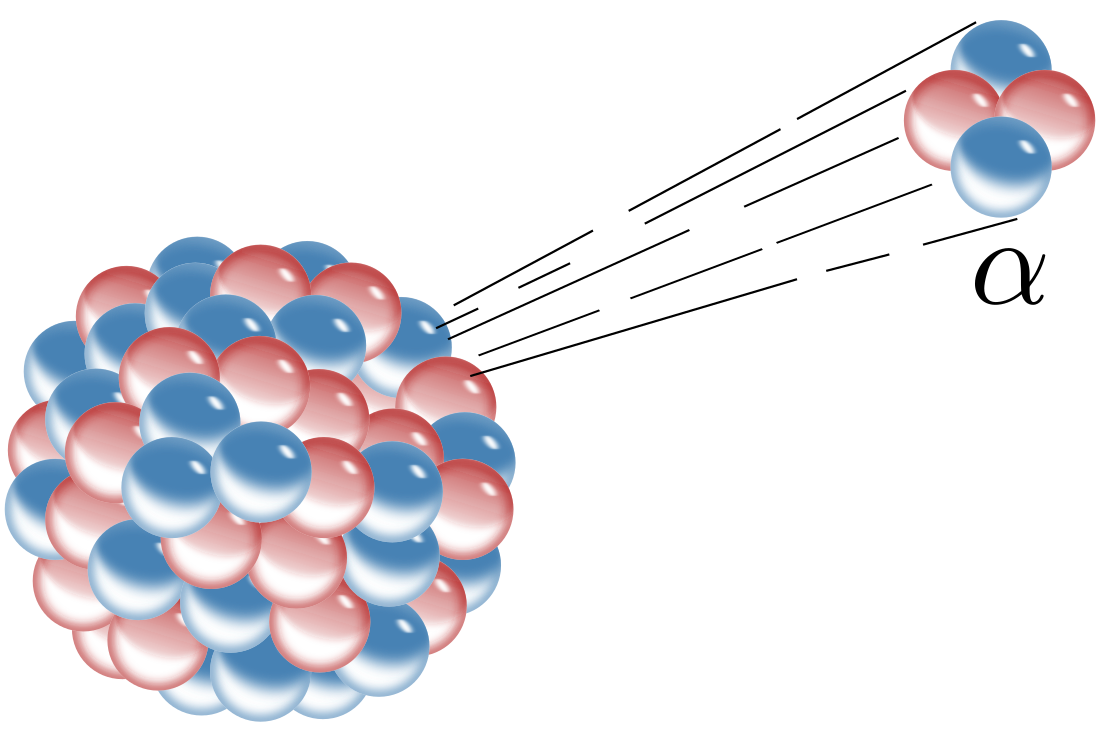
Le particelle alfa o raggi alfa (α) sono una forma di radiazione corpuscolare ad alto potere ionizzante e con una bassa capacità di penetrazione dovuta all'elevata sezione d'urto. Consistono di due protoni e due neutroni legati insieme dalla forza forte. Si tratta, quindi, di nuclei di elio-4 (4He). Da un punto di vista chimico possono anche essere identificati con il simbolo 4He++. Assieme all'isotopo elio-3 (3He) le particelle alfa appartengono alla famiglia degli elioni. Il decadimento beta è mediato dall'interazione debole, mentre il decadimento alfa è mediato dall'interazione forte.[1]
Remove ads
Descrizione
Riepilogo
Prospettiva
Le particelle alfa sono tipicamente emesse da nuclidi radioattivi degli elementi pesanti, per esempio dagli isotopi dell'uranio, del plutonio, del torio e del radio, in un processo denominato decadimento alfa. A volte questo decadimento lascia i nuclei in uno stato eccitato, e conseguentemente l'eccesso di energia può essere rimosso con l'emissione di raggi gamma.[2]
I raggi alfa, a causa della loro carica elettrica, interagiscono fortemente con la materia e quindi vengono facilmente assorbiti dai materiali e possono viaggiare solo per pochi centimetri nell'aria. Possono essere assorbiti dagli strati più esterni della pelle umana e così generalmente non sono pericolosi per la vita a meno che la sorgente non venga inalata o ingerita, come nel caso del gas Radon. In questo caso i danni sarebbero invece maggiori di quelli causati da qualsiasi altra radiazione ionizzante. Se il dosaggio fosse abbastanza elevato comparirebbero tutti i sintomi tipici dell'avvelenamento da radiazione.[3]
Nel 1909 Ernest Rutherford con i suoi assistenti Hans Wilhelm Geiger e Ernest Marsden, sfruttò le proprietà delle particelle alfa per confermare i suoi studi sugli atomi[4]. Egli misurò l'angolo con cui veniva riflesso un fascio di queste particelle da parte di una lamina d'oro sottile (spessa 0,00004 cm, contenente circa 1400 atomi) e trovò che solamente una piccola percentuale di queste particelle (1 su 20.000) veniva riflessa con un angolo maggiore di 90°. Erano queste le particelle che colpivano i nuclei, mentre le altre continuavano linearmente il loro spostamento: questo mostra come il raggio di un atomo (distanza nucleo-elettrone) sia circa 10 000 volte superiore del raggio del singolo nucleo (protoni e neutroni).[5]
L'esperimento di Rutherford cambiò la visione dell'atomo che si aveva all'epoca: si abbandonò il modello Thomson a panettone, a favore del nuovo modello atomico di Rutherford il quale, a sua volta, costituì la base per il modello proposto da Niels Bohr nel 1913.[6][7]
Remove ads
Note
Bibliografia
Voci correlate
Altri progetti
Collegamenti esterni
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads