トップQs
タイムライン
チャット
視点
インフラマソーム
ウィキペディアから
Remove ads
インフラマソーム(英: inflammasome)は細胞質に位置する多タンパク質オリゴマーであり、自然免疫系に関与し、炎症応答の活性化を担う[1][2]。インフラマソームの活性化と組み立ては、炎症性サイトカインであるIL-1βとIL-18の切断、成熟、分泌、そしてガスダーミンDの切断を促進する[2][3]。ガスダーミンDの切断によって生じたN末端断片は、パイロトーシスと呼ばれる、アポトーシスとは異なる炎症促進性のプログラム細胞死を誘導し、またおそらく細胞膜でのポアの形成を介して成熟型サイトカインの分泌を担う[2]。インフラマソームの活性化の調節異常によって、がん、自己免疫疾患、代謝疾患、神経変性疾患など、多くの主要な疾患が引き起こされる可能性がある[2][4]。
従来インフラマソームは、主にマクロファージなど自然免疫系の専門細胞で研究が行われてきた。しかし近年の研究では、上皮バリア組織においてもインフラマソームの構成要素の発現レベルが高いことが示されており、そこで重要な防御の最前線となっていることが示されている[5]。インフラマソームの活性化は細胞質のさまざまな種類のパターン認識受容体(PRR)によって開始され、これらは微生物由来の病原体関連分子パターン(PAMP)または宿主細胞によって産生されるダメージ関連分子パターン(DAMP)のいずれかに応答する[5]。インフラマソームに関与するPRRとしてはNOD様受容体(NLR)やAIM2(absent in melanoma 2)、IFI16(IFN-inducible protein 16)やパイリン(Pyrin)などがある[2]。
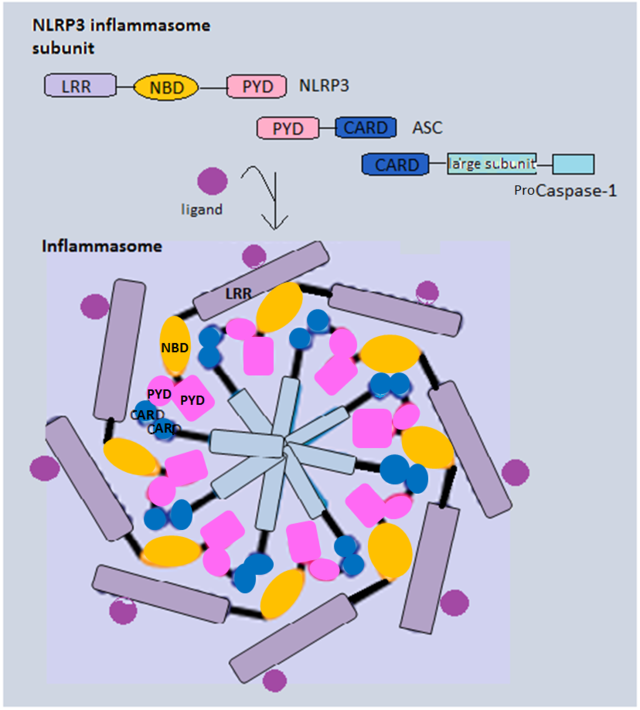
インフラマソームの受容体はCARD(caspase activation and recruitment domain)またはPYD(pyrin domain)を介してアダプタータンパク質ASCと相互作用する。ASCは自身のCARDドメインを介してカスパーゼ-1前駆体をリクルートし、タンパク質の分解切断によってエフェクターカスパーゼを活性化する[2]。活性化されたカスパーゼ-1は最終的に、未成熟な炎症性サイトカインであるIL-1β前駆体とIL-18前駆体、そしてガスダーミンDを切断する。これらはそれぞれ炎症シグナル伝達とパイロトーシスによる細胞死を担う[2]。こうしたいわゆる古典的インフラマソーム(canonical inflammasome)に加えて、カスパーゼ-1とは独立して作用する非古典的インフラマソーム(non-canonical inflammasome)複合体についても記載されている。マウスでは、非古典的インフラマソームはカスパーゼ-11による細胞質に存在する細菌由来のリポ多糖(LPS)の検知によって直接活性化され、その後パイロトーシスによる細胞死を誘導する[2]。ヒト細胞では、非古典的インフラマソームのカスパーゼはカスパーゼ-4とカスパーゼ-5である[2]。
Remove ads
歴史
インフラマソームは2002年にローザンヌ大学のJürg Tschoppのチームによって発見された[3][6]。Tschoppらは痛風や2型糖尿病におけるインフラマソームの役割を明らかにした[6]。彼らはウイルスDNA、ムラミルジペプチド(MDP)、アスベスト、シリカなどさまざまな危険シグナルがインフラマソームの応答を引き起こすことを発見し、NLRP3インフラマソームとメタボリックシンドロームとの関係を発見した[6]。また、NLRP3が阻害された場合には、I型インターフェロンによる免疫抑制がみられることを示した[6]。Tschoppらによる研究は、最終的には多くの主要な疾患の研究と治療につながった[6]。2002年に最初に報告されたのは、NLRP1と呼ばれるNLRがオリゴマー化してカスパーゼ-1カスケードを活性化する構造へと組み立てられ、炎症性サイトカイン、特にIL-1βとIL-18の産生が行われることである。このNLRP1多分子複合体は「インフラマソーム」と命名され、多くの関心を集めた。その後、他のインフラマソームがいくつか発見され、そのうちの2つはNLRP3、NLRC4と呼ばれるNLRであった。2009年にHornungら[7]は、PYHIN(pyrin and HIN domain-containing protein)ファミリーのインフラマソームを分類し、AIM2(absent in melanoma 2)と名付けた。AIM2は、細胞質に侵入した外因性の二本鎖DNAを検知して組み立てられる。近年では、アダプタータンパク質ASCのPYDが、活性化に伴ってプリオン様ドメインとして自己増殖する機能を果たすことが示されている[8]。
Remove ads
自然免疫における役割
感染の際に自然免疫応答が最初にとる防御方法の1つは、侵入した病原体が発現している分子パターン(PAMP)を認識する、パターン認識受容体(PRR)の利用である。こうした受容体には、Toll様受容体(TLR)やC型レクチン受容体(CLR)のように膜表面に存在するものと、NOD様受容体(NLR)やRIG-I様受容体(RLR)のように細胞質に存在するものがある。インフラマソーム複合体は、微生物由来のさまざまなPAMPや細胞自身が生成するDAMPを認識する細胞質のPRRの一部によって活性化される[5]。インフラマソームは自然免疫系の一部として、炎症性サイトカインの活性化と分泌、およびパイロトーシスと呼ばれる特殊な免疫刺激性プログラム細胞死の誘導を介して、炎症カスケードの誘導と宿主防御の調整に重要な役割を果たしている[2]。従来、インフラマソームは主にマクロファージなどの自然免疫系の専門細胞で研究されてきた。しかし近年になって、いくつかの研究によってさまざまな上皮のインフラマソームが記載され、防御の最前線としての重要性が強調された[5][9]。腸などの重要なバリア組織には上皮細胞が存在するため、上皮のインフラマソームは侵入した微生物を最初の相互作用点で認識する最適な位置にある。
Remove ads
炎症カスケード
インフラマソームはパイロトーシスカスケードの活性化を行い、その機構はアポトーシスカスケードを活性化するアポトソームと類似している[10]。インフラマソームは活性化されると、自身のCARD、またはインフラマソーム形成時に結合するアダプタータンパク質ASCのCARDを介して、カスパーゼ-1前駆体と同型結合を行う。完全な形のインフラマソームは多数のp45カスパーゼ-1前駆体分子を結合し、p20、p10サブユニットへの自己触媒切断を誘導する[11]。その後、カスパーゼ-1はp20、p10サブユニットのヘテロ二量体から構成される活性型構造へと組み立てられる。活性型となったカスパーゼ-1は炎症の初期シグナルに応答してさまざまな過程に従事する。そうした過程には、IL-1β前駆体のAsp116での切断によるIL-1βの形成、IL-18前駆体のIL-18への切断、パイロトーシスの誘導を担うガスダーミンDのN末端断片の放出などが含まれる。パイロトーシスは細胞が細胞質の内容物を放出して炎症性シグナルを誘導する、免疫刺激性のプログラム細胞死である[2][12]。インフラマソームの活性化後に放出されるIL-1βとIL-18は、IFN-γの分泌とNK細胞の活性化[13]、IL-33の切断と不活性化[14]、DNAの断片化と膜でのポアの形成[15]、解糖系の酵素の阻害[16]、脂質の生合成の活性化[17]、IL-1α前駆体などの組織修復メディエーターの分泌[18]を誘導することが判明している。また、AIM2は細胞質の外因性二本鎖DNAを検知して結合し、NF-κBを活性化するHIN200ドメインを持ち、細菌とウイルスの感染に重要な役割を果たす[7][19]。
NLRファミリーのインフラマソーム
要約
視点
NLRP1、NLRP3、NLRP6、NLRC4はNLRファミリーに属し、2つの共通した特徴を有する。1つはリボヌクレオチド三リン酸(rNTP)が結合するNOD(nucleotide-binding oligomerization domain)であり、自己オリゴマー化に重要である[20]。もう1つはC末端のロイシンリッチリピート(LRR)であり、他の受容体(TLRなど)や微生物リガンドに対するリガンド認識ドメインとして機能する。NLRP1は神経細胞に存在する一方、NLRP3とNLRC4はミクログリア細胞で同定されている[21]。
NLRP1
→「NLRP1」も参照
構造
NLRP1はNODとLRRに加えて、N末端にPYD、C末端にFIINDモチーフとCARDを持つ点で他のインフラマソームと異なる。ヒトではNLRP1タンパク質は1種類しか存在しないが、齧歯類では異なるパラログの存在が知られている[2]。活性化に伴って、C末端のCARDはカスパーゼ-1前駆体またはカスパーゼ-5前駆体のCARDと同型相互作用を行うのに対し、N末端のPYDはアダプタータンパク質ASCのPYDと同型相互作用を行い、ASCのCARDがさらに他のカスパーゼ-1をリクルートする。こうしたカスパーゼ-1のリクルートと切断がカスパーゼ-1の下流のすべての経路を活性化する。
活性化
ラットのNLRP1BとNLRP2は炭疽菌Bacillus anthracisの致死因子に応答することが知られている[2]。炭疽菌致死因子はNLRP1Bを切断し、受容体のユビキチン化とプロテアソーム分解への標的化を行う。この分解によって生じたC末端断片は、タンパク質の残りの部分と非共有結合的に結合する。この過程を通じて、C末端断片に位置するCARDはインフラマソームの組み立てのためにアクセスが可能となる[5]。現在のところ、こうしたプロテアソームによる分解に依存した活性化機構はインフラマソームの中でも独特のものである[5]。
NLRP1の活性は抗アポトーシスタンパク質Bcl-2、Bcl-xLによって調節されている。静止細胞では、これらのタンパク質はNLRP1に結合してその活性を阻害している[22]。
NLRP3
→「NLRP3」も参照
構造
NLRP3はNODとLRRに加えて、NLRP1と同様にPYDを持ち、それによって同様にPYDを用いてASCをリクルートし、カスパーゼ-1を活性化する。NLRP3は細胞当たり1つのオリゴマーしか形成せず、そのオリゴマーは7分子のNLRP3から形成される。インフラマソームの中で最も大きいことが知られており、直径は約2 μmである[23]。
活性化
NLRP3のオリゴマー化は、PAMPやDAMPを含む多数の刺激によって活性化される。DAMPによる刺激の例としては、尿酸一ナトリウム(MSU)結晶、ミョウバン、アスベストなどの結晶質、カルシウムの流入、ミトコンドリアの活性酸素種(ROS)、細胞外のATPなどがある[2][24]。NLRP3インフラマソームは、A型インフルエンザなどのウイルス[25]、淋菌Neisseria gonorrhoeaeなどの細菌[26]、ニゲリシンやマイトトキシンなどの細菌毒素など、さまざまな病原体由来のPAMPにも応答することが知られている[1]。さまざまなNLRP3刺激は、細胞内のカリウム濃度の低下へと集約される[2]。コレステロールやMSUの結晶によるNLRP3インフラマソームの活性化はNLRP3によるIL-1βの産生を増加させ[27][28]、この過程はアテローム性動脈硬化や痛風など、これらの結晶が細胞内に存在する疾患では異常が生じていると考えられている。二酸化チタンや二酸化ケイ素、アスベストなどの無機粒子もインフラマソームの活性化を開始させることが示されている[29]。ある研究では、NLRP3インフラマソームの活性化が睡眠の調節に関与していることも示唆されている[30]。近年の研究では、NLRP3インフラマソームを介した神経炎症が脳内出血後の二次性脳損傷に関与していることが示されている[31]。
阻害
NLRP3阻害剤の開発が進行しており、ダパンストリル、ジアリールスルホニルウレアMCC-950などが開発されている[32][33]。
NAIP/NLRC4
→「NLRC4」も参照
構造
NLRC4(IPAFとも呼ばれる)は、インフラマソームを形成することが知られている唯一のNLRCファミリーのメンバーである。NODとLRRに加えてCARDのみを持ち、CARDを用いてアダプタータンパク質ASCまたは直接カスパーゼ-1前駆体をリクルートする。他のインフラマソームとは異なり、NLRC4はNAIP(NLR family apoptosis inhibitory proteins)と呼ばれるタンパク質群を上流の受容体として利用する[2]。
活性化
NAIP/NLRC4インフラマソームは宿主の防御機構と関係している[34]。NAIPは細胞質基質に存在する細菌由来のPAMPに結合することで活性化される。マウスではNAIP1は細菌のIII型分泌装置(T3SS)のニードル、NAIP2はロッド、そしてNAIP5とNAIP6は鞭毛の構成要素であるフラジェリンを認識する[2][35]。リガンドの結合後、NAIPはNLRCと相互作用してNAIP/NLRC4インフラマソームの組み立てを開始し、その後NAIP/NLRC4インフラマソームはCARDドメインを介してカスパーゼ-1前駆体をリクルートして活性化する[35]。
細菌が存在しない場合でも、パルミチン酸はNLRC4インフラマソームを誘導することが実験的に示されている。このことは免疫系においてインフラマソームが持つ他の機能を示唆するものであり、また、インフラマソームが細菌以外にも反応することを示唆している。NLRC4インフラマソームは、環状アデノシン一リン酸(cAMP)によって調節される[34]。
アダプタータンパク質ASC
ASC(apoptosis-associated speck like protein containing a caspase recruitment domain)またはPYCARDは、インフラマソームの活性化に重要な役割を果たす[4]。ASCは自身のCARDドメインを介して、カスパーゼ-1がインフラマソーム複合体のNLRと結合するのを助ける[36]。
ASCは、MHCクラスII分子が樹状細胞に抗原ペプチドを提示するために必要であることが示されているように、インフラマソームとは独立した役割も担っている[4]。
Remove ads
AIM2とIFI16
AIM2
→「AIM2」も参照
構造
AIM2は343アミノ酸からなる非NLRファミリーのタンパク質で、DAPINドメイン(PYD)とHIN200ドメインを持つ[37]。HIN200ドメインは二本鎖DNA(dsDNA)を結合する[38]。
機能
AIM2インフラマソームは細胞質基質に存在するdsDNAを検知し、DNAウイルスの感染や細菌の細胞内感染に対する免疫防御の調整に重要な役割を果たす[2]。AIM2はウイルスや細菌のdsDNA、さらに宿主の異常なdsDNAによっても活性化される[39][40]。そのため、ヒトのさまざまな疾患とも関連している。例えば、乾癬における自己炎症反応はAIM2による自己DNAの認識と関連付けられている[2]。さらに、AIM2の活性化は自己免疫疾患である全身性エリテマトーデスにおける自己免疫応答にも関与していると考えられている。AIM2インフラマソームは薬剤による核膜の完全性の破壊によっても活性化される[41]。AIM2はC末端のHIN200ドメインでdsDNAに結合する[39][42][43]。AIM2のPYDはASCとPYD-PYD同型相互作用を行う。ASCのCARDドメインはカスパーゼ-1を複合体へリクルートし、カスパーゼ-1は炎症性サイトカイン(IL-1β、IL-18)の成熟を活性化する。
IFI16
AIM2と同様に、IFI16はPYHIN(pyrin and HIN domain-containing)ファミリーに属する。ヒトのIFI16、マウスのオルソログIFI204は細菌やウイルスの感染時のインターフェロンの産生の調節に重要な役割を果たす[2]。AIM2とは対照的に、IFI16は核内のDNAのセンサーである[5]。ウイルスDNAによって活性化された後、IFI16はASCとの相互作用を介してカスパーゼ-1をリクルートする。HIV感染時のCD4+T細胞の細胞死に寄与することが知られている[2]。
Remove ads
パイリン
パイリン(pyrin)はMEFV遺伝子によってコードされ、TRIM20、マレノストリン(marenostrin)とも呼ばれる[2]。
構造
パイリンは2つのPYD、2つのBボックス、コイルドコイルドメイン、そしてC末端にはB30.2ドメインが存在する。B30.2ドメインはヒトのパイリンにのみ存在する[2]。
機能
パイリンインフラマソームは細菌の毒素やエフェクタータンパク質によってその組み立てが開始され、病原体によって駆動される細胞骨格のダイナミクスの乱れが検知される[2]。具体的には、パイリンは細菌性因子によるRho GTPアーゼ RHOAの不活性化を検出する[2]。RHOAの不活性化が検出されると、パイリンはN末端のPYDを介してASCと相互作用し、カスパーゼ-1の活性化を誘導する[2]。
非古典的インフラマソーム
非古典的インフラマソーム(non-canonical inflammasome)という名称は、これらのインフラマソーム複合体がカスパーゼ-1に依存しないことに由来する。マウスでは非古典的インフラマソームはカスパーゼ-11に依存しているのに対し、ヒトの非古典的インフラマソームはカスパーゼ-4とカスパーゼ-5に依存している[2]。これらのカスパーゼは全て、細胞内のLPSに直接結合し、その後ガスダーミンDの切断とパイロトーシスによる細胞死を誘導する高分子複合体を形成する[5]。さらに、非古典的インフラマソームはガスダーミンDによって形成される膜のポアを介してカリウムの流出の引き金を引くことで、間接的にNLRP3インフラマソームを活性化している可能性がある[5]。その後、NLRP3インフラマソームが炎症性サイトカインのプロセシングを媒介することで、非古典的インフラマソームの活性化に応答したIL-1βとIL-18の放出が行われる[2]。
Remove ads
上皮インフラマソーム
要約
視点
従来、インフラマソームは主にマクロファージなど自然免疫系の専門細胞で研究が行われてきた。しかし近年の研究では、インフラマソームを介した防御は上皮のさまざまな部位において、細菌の攻撃に対する防御の最前線として重要な役割を果たしていることが示されている[5][9][44]。環境との接点に位置する上皮が病原体の一般的な侵入部位として重要であることを考えると、上皮組織が単に物理的バリアとしての機能を果たすだけでなく、病原体との最初の接触時に防御反応を開始することは直感的に理解される。実際に、さまざまなインフラマソームの構成要素がさまざまな上皮組織で発現していることが知られている[5][9]。病原体の侵入時に上皮バリアを突破するためには病原性因子の発現、したがってPAMPの露出が必要であるため、上皮バリアでの自然免疫構成要素の発現は病原体の検知をさらに促進する。一方、感染のより後の段階で専門免疫細胞と相互作用する際には、これらの因子はダウンレギュレーションされている可能性がある[44]。上皮インフラマソームは主に腸管粘膜で研究が行われてきたが、膀胱上皮など他のタイプの上皮でもインフラマソームが存在する証拠が得られている[44]。
上皮NAIP/NLRC4
NAIP/NLRCインフラマソームは最もよく記載されている上皮インフラマソームであり、サルモネラや腸粘膜肥厚症菌Citrobacter rodentiumなどの腸内細菌科細菌の感染の初期段階における上皮内の細菌集団の制限に重要な役割を果たす[9][44]。細胞内の細菌はインフラマソーム活性化の引き金となり、細菌量を減少させるために感染細胞の上皮からの特異的排除が引き起こされる[9][44]。この過程はepithelial cell extrusionとも呼ばれ、上皮バリアの完全性を損なうことなく行われる。さらに、大腸がんのマウスモデルにおいて、NAIP/NLRCインフラマソームはがん幹細胞を除去することで腫瘍量を減少させることが示されている[9]。
上皮の非古典的インフラマソーム
マウスのカスパーゼ-11は主にマクロファージで発現しているが、ヒトのカスパーゼ-4は腸管上皮細胞でも高いレベルで発現している[9]。上皮のNAIP/NLRC4インフラマソームで観察されているのと同様に、ヒトの上皮細胞ではサルモネラ、フレクスナー赤痢菌Shigella flexneri、大腸菌Escherichia coliなどの腸管病原体の感染に応答して、カスパーゼ-4依存的・カスパーゼ-1非依存的な細胞死と排除が行われる[9]。さらに、上皮細胞では細胞質基質に存在するLPSによってIL-18の分泌も開始される[9]。
上皮インフラマソームの活性化の影響
侵入病原体に対する応答としての上皮インフラマソームの活性化は、感染細胞自身に対する細胞自律的な影響とともに、局所的・全体的レベルで他の細胞種とのコミュニケーションにも影響を与える[44]。こうしたインフラマソームの活性化の下流の影響は、(1) 上皮細胞自身の細胞死、(2) 可溶性炎症促進分子の放出、(3) エフェクター細胞のリクルートと活性化、という3つのカテゴリに分類される[44]。
上皮細胞の細胞死
上皮バリアの完全性を維持するためには、感染細胞の細胞死とその後の排除は、隣接細胞によって上皮の隙間を埋めるよう協調的に行われる必要がある[44]。上皮細胞の細胞死はインフラマソームの活性化自体や細胞死を誘導する他の細胞種の局所的なリクルートによって直接的かつ細胞自律的に開始されるか、または全体的な炎症によって上皮のターンオーバーを増加させることで感染細胞と非感染細胞の双方を除去することで行われる[44]。上皮細胞の細胞死の最も重要な帰結は、バリアの完全性を維持するための上皮の病原体の減少である[44]。
可溶性免疫メディエーターの放出
インフラマソームの活性化は炎症促進性のIL-1βとIL-18の切断、活性化と分泌を開始することが知られており、その後これらはさまざなタイプのエフェクター細胞をリクルートして自然免疫応答を調整する[44]。IL-1β前駆体の発現はTLRシグナルに依存しており、そのため腸管上皮細胞ではIL-1βの産生レベルは非常に低い。一方、IL-18前駆体はさまざまな種類の上皮細胞で恒常的に発現しており、インフラマソームの活性化に伴って速やかに分泌される[44]。上皮から分泌されたIL-18は、さまざまな細胞種からのIFN-γの産生を誘導する。
エフェクター細胞のリクルートと活性化
重要なことに、インフラマソームに由来するIL-18はNK細胞のリクルートにも関与しており、NK細胞は自然免疫応答の初期段階で重要な役割を果たす[44]。さらに、IL-18は感染部位に蓄積したNK細胞のエフェクター機能を刺激する[44]。上皮細胞での自律的な細胞死の誘導と比較して、NK細胞の活性化はより後の時点で病原体の量と全身への拡散の制限を補助する[44]。NK細胞は他の炎症性細胞種をリクルートするためにIFN-γの分泌も行う[44]。
膀胱上皮での尿路病原性大腸菌感染の研究では、膀胱上皮細胞は細菌感染に応答してIL-1βを高いレベルで分泌することが示されている。IL-1βの分泌はNLRP3インフラマソームとカスパーゼ-1に依存しており、分泌された炎症性サイトカインは感染部位へのマスト細胞のリクルートに必要である。その後、マスト細胞は上皮に取り込まれる顆粒を分泌することで、上皮での細胞溶解性の細胞死を誘導する[44]。
NK細胞とマスト細胞に加えて、好中球も自然免疫のエフェクター細胞として重要であり、病原体によって上皮バリアが突破された後の感染組織に浸潤する。インフラマソームの活性化に応答して分泌されるIL-1βとIL-18の双方が好中球のリクルートに関与している[44]。感染組織に到達すると、好中球は侵入病原体の固定や除去を補助し、微生物を直接取り込むかもしくは殺す[44]。さらに、好中球はIFN-γやIL-22などの炎症メディエーターを分泌する。IFN-γは単核食細胞の殺菌能力の活性化を駆動することが知られている。IL-22は上皮バリアを強化すると考えられている[44]。好中球はパイロトーシスを起こしたマクロファージ内に捕らえらえた細菌の除去も担う[44]。
Remove ads
活性調節の異常
インフラマソームの調節の問題は、1型、2型糖尿病、炎症性腸疾患(IBD)、痛風性関節炎、多発性硬化症、尋常性白斑などのいくつかの自己免疫疾患や自己炎症性疾患と関連付けられている[4][45]。これらの疾患や障害は、インフラマソームが担う炎症性サイトカインの分泌量の過剰や過少と関係している。また、インフラマソームの構成要素の機能獲得変異は、IL-1βを介した全身の炎症を特徴とする先天性疾患群であるクリオピリン関連周期熱症候群(CAPS)を引き起こすことが知られている。
出典
関連文献
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads
