トップQs
タイムライン
チャット
視点
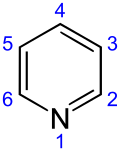
ピリジン
ウィキペディアから
Remove ads
ピリジン (pyridine) は化学式 C5H5N、分子量 79.10 の複素環式芳香族化合物のアミンの一種である。ベンゼンに含まれる6つの C−H 構造のうち1つが窒素原子に置き換わった構造をもつ。融点 −41.6℃、沸点 115.2℃。 腐り果てた魚のような臭いを発する液体である。
石油に含まれるほか、誘導体(ピリジンアルカロイド)が植物に広範に含まれる。ニコチンやピリドキシンなどもピリジン環を持つ。酸化剤として知られるクロロクロム酸ピリジニウム (PCC) の原料として重要。また有機合成において溶媒として用いられる。
消防法による危険物(第四類 引火性液体、第一石油類(水溶性液体)(指定数量:400L))に指定されており、一定量以上の貯蔵には消防署への届出が必要である。
Remove ads
物性

ベンゼンとよく似た構造を持ち、ピリジンの窒素原子はsp2混成している。窒素原子は芳香族π共役系に 1電子を提供しており、炭素から提供された 5電子をあわせると 6電子となりヒュッケル則を満たすため、芳香族としての性質を示す。
ピリジンはベンゼンと同じように無極性溶媒に容易に溶けるが、極性溶媒である水にも溶ける。これはピリジンの窒素原子が水と水素結合を形成して溶媒和するためである。 窒素は炭素と比べて電気陰性度が高いため、分子内で窒素原子がわずかに負電荷を、残りの部分は陽電荷を帯び極性が生じていることも、極性溶媒に溶ける大きな要因である。
ピリジンはアミン類と同様に塩基性を示す。しかしその塩基性はアミンと比べてきわめて弱い。これは窒素原子の混成の差によるものである。
反応
要約
視点
ピリジンは酸と反応して塩を作る。これはピリジニウム塩と総称される。塩化水素とは以下のように反応し塩化ピリジニウムとなる。
求電子置換反応
ピリジンは芳香族でありながら、ニトロ化やアシル化などの求電子置換反応を受けにくい。そのためには強い酸触媒と高温条件が必要になり、収率も低いことが多い。この理由は、窒素の電気陰性度のために環がわずかに電子不足であることと、求電子置換反応は通常酸性条件下で行われるので、ピリジン窒素がプロトン化を受けて環の電子密度がさらに低下するためである。
置換反応は主に C-3位に起こる。これは陽イオン中間体であるピリジニウムイオンの陽電荷が C-2,4位に非局在化しており、それらの位置が求電子的攻撃を受けにくいためである。
求核置換反応
求電子置換反応に比べ、求核置換反応は起こりやすい。例えば、2-クロロピリジンや2-ブロモピリジンは酸性条件でヨウ化物イオンを作用させて、2-ヨードピリジンに変えることができる[4]。酸の付加により環が陽電荷を帯び、求核剤の攻撃を受けやすくなるためである。
ラジカル反応
ピリジンは一連のラジカル反応を起こす。これは二量化によるビピリジンの形成に使われる。金属ナトリウムまたはラネーニッケルを使ったピリジンのラジカル二量化により4,4'-ビピリジン[5]または2,2'-ビピリジン[6]が選択的に得られる。これらは化学産業における重要な前駆体試薬である。フリーラジカルが関与する人名反応の1つがミニスキ反応である。この反応は硫酸酸性条件でピリジンとピバル酸、硝酸銀、アンモニウム塩を反応させて、97%の収率で2-tert-ブチルピリジンを生成することができる[7]。
酸化
ピリジンまたはその誘導体を過酸化水素や過カルボン酸などで酸化すると、環の窒素上に酸素原子が結びついたピリジン N-オキシドが生成する[8]。ピリジン N-オキシドに対しては混酸によるニトロ化などの求電子置換反応を行うことができ、それらは4位へと選択的に起こる。ピリジン窒素上の酸素は三臭化リンなどにより後に除去することができるため、ピリジンの 4-ニトロ化物を合成したい場合に N-オキシドを通る経路は有力である。
Remove ads
ピリジン環を有する化合物
有機反応試剤
- N,N-ジメチル-4-アミノピリジン - 求核性の触媒・塩基。
- ピコリン - ピリジンにメチル基が1つついた化合物。
- ビピリジン - 二座配位子。
- 2,6-ルチジン - 求核性の低い塩基。
- クロロクロム酸ピリジニウム - 酸化剤。
- ピリジニウムパラトルエンスルホナート - 酸触媒。
天然物
農薬
殺菌消毒薬
関連項目
脚注
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads





![{\displaystyle {\mathrm {C} {\vphantom {A}}_{\smash[{t}]{5}}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{5}}\mathrm {N} \ {}+{}\mathrm {HCl} {}\mathrel {\longrightarrow } {}\mathrm {C} {\vphantom {A}}_{\smash[{t}]{5}}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{5}}\mathrm {N} {\vphantom {A}}^{+}\ \mathrm {H} ~\cdot \mathrm {Cl} {\vphantom {A}}^{-}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/ce3aac39d10e30420095b4aa6fa4dc9645cdc0f9)