トップQs
タイムライン
チャット
視点
パイロトーシス
ウィキペディアから
Remove ads
パイロトーシスまたはピロトーシス(英: pyroptosis)は、きわめて炎症性の高い、細胞溶解性プログラム細胞死の一形態である。パイロトーシスが最も高頻度で生じるのは細胞内病原体の感染時であり、抗微生物応答の一部を構成している。この過程は、さまざまな細菌、ウイルス、真菌、原生動物による感染時に細胞内の複製ニッチを除去し、宿主の防御応答を高めることで病原体の迅速な除去を促進する[1]。パイロトーシスの例としては、サルモネラが感染したマクロファージやHIVのabortive infection(不完全な感染)時のヘルパーT細胞に生じる細胞死が挙げられる[2][3][4]。パイロトーシスは免疫細胞で生じることが一般的であるが、ケラチノサイトや一部の上皮細胞でも生じることが報告されている[1]。
パイロトーシス過程は、細胞内のdanger signalによってインフラマソーム(またはpyroptosome)と呼ばれる巨大な超分子複合体が形成されることで開始される[5]。インフラマソームによって活性化されるのはアポトーシス時とは異なるセットのカスパーゼであり、ヒトではカスパーゼ-1/4/5、マウスではカスパーゼ-11が活性化される[6]。これらのカスパーゼは炎症性サイトカインであるIL-1βやIL-18、ポアを形成するガスダーミンD(GSDMD)の成熟と活性化に寄与する。ポアの形成によって細胞膜は破裂し、サイトカインのほか、HMGB1、ATP、DNAなどのダメージ関連分子パターン(DAMP)分子が細胞外へ放出される。これらの分子はより多くの免疫細胞を動員し、組織内の炎症カスケードをさらに持続させる[7][8]。
病原体による慢性疾患では炎症応答は主要な刺激の除去には至らず、最終的には組織損傷に寄与する慢性的な炎症が引き起こされる。パイロトーシスが関連した疾患には、自己免疫疾患、代謝疾患、心血管疾患、がんや神経変性疾患が含まれる。
Remove ads
発見
この種の炎症性プログラム細胞死がパイロトーシス(pyroptosis)と命名されたのは、2001年にワシントン大学のBrad T. CooksonとMolly Brennanによってである[9]。ギリシャ語の"pyro"は「火」を意味し、"ptosis"は「落ちる」を意味する。合成語である"pyroptosis"という語は「燃えるように落ちること」を意味すると理解され、死につつある細胞から炎症性化学シグナルが一気に放出されるさまを表している。パイロトーシスは他の細胞死形態とは形態学的にも機構的に異なっており[10]、この経路の主要な進化圧となったのは微生物感染であることが示唆されている[11]。当初はパイロトーシスの誘導にはインフラマソームの形成が必要であると考えられていたが、2013年にカスパーゼ-11依存的な非古典的経路が発見され、リポ多糖(LPS)がTLR4非依存的にパイロトーシスやその後の炎症応答を開始することができることが示唆された[12]。2015年には、ガスダーミンDが細胞膜にポアを形成する、パイロトーシスのエフェクター分子であることが同定された[6][13]。2021年、ガスダーミンDのポアの高分解能構造がクライオ電子顕微鏡解析によって解かれた[14]。また同年、パイロトーシス時の細胞膜の破裂にはNINJ1も必要であることが発見された[15]。
Remove ads
形態学的特徴
プログラム細胞死の一形態であるパイロトーシスには、アポトーシスと比較した際に多くの形態学的差異がみられる。パイロトーシスとアポトーシスはどちらもクロマチン凝縮が生じるものの、アポトーシスでは核は複数のクロマチン小体へと断片化するのに対し、パイロトーシスでは無傷なままである[16]。パイロトーシスを起こした細胞では、細胞膜にガスダーミンによるポアが形成され、水の流入が引き起こされる[1][17]。
機構という面では、パイロトーシスはヒトではカスパーゼ-1/4/5、マウスではカスパーゼ-11など、炎症性カスパーゼによって活性化される。カスパーゼ-8は状況依存的にインフラマソーム活性化の上流の調節因子として作用する場合がある[18]。カスパーゼ-3の活性化はアポトーシスとパイロトーシスの双方で生じる[1][17]。
また、パイロトーシスとネクロトーシスはどちらも膜でのポア形成によって開始されるが、パイロトーシスの方がより制御された形で行われる。パイロトーシスを起こした細胞では膜のブレブ形成が生じ、pyroptotic bodyと呼ばれる突起が形成されるが、この過程はネクロトーシスでは発見されていない[19]。
Remove ads
機構
要約
視点
自然免疫系は、ゲノムにコードされたパターン認識受容体(PRR)を用いることで、微生物感染時の広範囲の病原体関連分子パターン(PAMP)やダメージ関連分子パターン(DAMP)を認識することができる。PRRの典型的な例としては、Toll様受容体(TLR)やNOD様受容体(NLR)が挙げられる[20]。PAMPやDAMPの認識によって多タンパク質複合体であるインフラマソームの形成が開始され、その後カスパーゼが活性化されてパイロトーシスが開始される。インフラマソーム経路には古典的(canonical)経路と非古典的(noncanonical)経路があり、前者ではカスパーゼ-1を活性化するインフラマソームが用いられ、後者ではそれ以外のカスパーゼが利用される[21]。
古典的インフラマソーム経路
古典的インフラマソーム経路では、PAMPやDAMPは特定の内在性PRRによって認識される。一例として、NLRタンパク質NLRC4はフラジェリンやIII型分泌装置の構成要素を認識する[22]。NLRP3はさまざまなPAMPやDAMP刺激によって誘導される細胞イベントを通じて活性化される[23]。AIM2やPyrinなどNLR以外の一部のタンパク質も、活性化されてインフラマソームを形成することができる[21]。また、TLRやNOD1、NOD2などインフラマソームを形成しないPRRもパイロトーシスに重要な役割を果たしている。これらの受容体はNF-κBやMAPKシグナル伝達経路を介してIFN-α/β、TNF、IL-6、IL-12などの炎症性サイトカインの発現をアップレギュレーションする[24][25]。
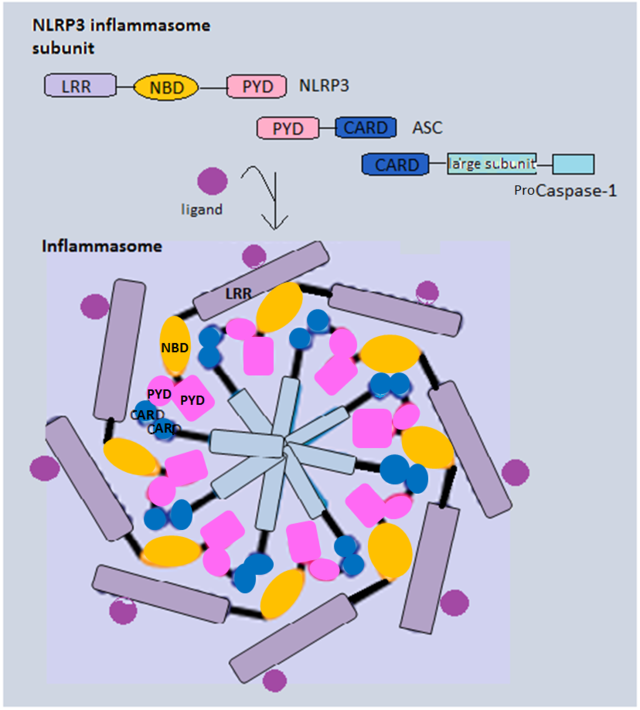
古典的インフラマソーム経路には、センサー(PRR)、アダプター(ASC)、エフェクター(カスパーゼ-1)の3つの構成要素が主に含まれる[21]。一般的にインフラマソームを形成するNLRタンパク質は、いくつかのロイシンリッチリピート(LRR)ドメイン、ヌクレオチド結合・オリゴマー化ドメイン(NBD)、Pyrinドメイン(PYD)という共通の類似した構造を有している。一例として、NLRP3はPYD-PYD間相互作用によってアダプタータンパク質ASCをリクルートする。カスパーゼ-1前駆体とASCにはCARD(caspase activation and recruitment domain)が存在し、両者のCARD-CARD間相互作用によって自己触媒切断、そしてカスパーゼ-1前駆体から活性型カスパーゼ-1を形成するための再組み立てが可能となる[26]。また、NLRC4はPYDの代わりにCARDを有しているため、直接カスパーゼ-1前駆体をリクルートすることができる[27]。
活性化されたカスパーゼ-1は、IL-1β前駆体やIL-18前駆体の切断を担う。これらのサイトカインはプロセシングを受けることで、宿主細胞からの放出の準備が整った生物学的活性型状態となる。さらに、カスパーゼ-1は細胞質基質に位置するガスダーミンD(GSDMD)も切断する。切断によってGSDMDはN末端ドメイン(GSDMD-N)とC末端ドメイン(GSDMD-C)となり、GSDMD-Nはオリゴマー化して内径10–14 nmの膜貫通ポアを形成する[28]。このポアはIL-1βやIL-18、さまざまな細胞質基質の構成要素の細胞外空間への分泌を可能にし、また細胞のイオン勾配の崩壊をもたらす。そして浸透圧によって水の流入が引き起こされ、細胞は膨潤して破裂する。GSDMD-Nは切断前はGSDMD-Cによる自己阻害を受けており、正常条件下での細胞溶解は防がれている[29]。またGSDMD-Nは特定の脂質構成を有する細胞膜の内葉へ挿入されるだけであり[30]、パイロトーシス時の膜の破裂にはGSDMDの下流のNINJ1が必要であると考えられている[15]。
非古典的インフラマソーム経路
非古典的インフラマソーム経路は、グラム陰性菌のLPSが直接ヒトのカスパーゼ-4/5、マウスのカスパーゼ-11に結合することで開始される。これらのカスパーゼへのLPSの結合によって、オリゴマー化と活性化が促進される[12]。これらのカスパーゼはGSDMDを切断し、GSDMD-Nを遊離させパイロトーシスを開始させる。さらに、膜の透過性の増大に伴うカリウムイオンの流出によってNLRP3の活性化が引き起こされ、NLRP3インフラマソームの形成とカスパーゼ-1の活性化がもたらされる[21]。
カスパーゼ-3依存的細胞死経路
アポトーシスとパイロトーシスを関連づける経路も提唱されている。アポトーシスにおける実行期カスパーゼであるカスパーゼ-3は、GSDMDの切断と類似した形でガスダーミンE(GSDME)をN末端断片とC末端断片へ切断する[6]。アポトーシス細胞がマクロファージによって貪食されなかった場合には、GSDMEの発現はp53によってアップレギュレーションされる。その後、GSDMEはカスパーゼ-3によって活性化されて細胞膜にポアを形成する。また、GSDMEはミトコンドリア膜を透過化してシトクロムcを放出することも知られており、これによってさらにカスパーゼ-3の活性化とGSDMEの切断が加速される[31]。
Remove ads
臨床的意義
要約
視点
感染症
パイロトーシスは炎症を誘発することで感染に対する防御機構として作用する。インフラマソームの形成とカスパーゼ-1の活性によって、病原体と除去と疾患の間のバランスが決定される。
健康な細胞では、カスパーゼ-1の活性化は細胞死を誘導して病原体の成長を制限することで、サルモネラや赤痢菌による感染との闘いを補助している[2]。Danger signalが検知された場合には、静止状態の細胞がパイロトーシスを起こしてIL-1βやIL-18といった炎症性サイトカインを産生するために活性化される。IL-18はIFN-γの産生を刺激し、TH1応答を開始させる(TH1応答は病原体の迅速な除去を指示するサイトカインを放出する傾向がある)[32]。細胞の活性化はサイトカイン濃度の上昇を引き起こし、感染進行時の炎症の影響の増強、そして獲得免疫応答の形成に寄与する。一方、持続的な炎症は過剰に免疫細胞を生み出し、有害なものとなる。増幅サイクルが持続された場合には、代謝異常、自己免疫疾患、慢性炎症と関連した肝障害が生じる[32]。
近年、パイロトーシスとその下流の経路はCOVID-19と関連した重症疾患の治療における有望な標的として同定されている[33]。
脳血管疾患
パイロトーシスは脳内出血の病理に関与していることが示されており、パイロトーシスの緩和は脳内出血後の炎症応答を阻害する介入戦略の1つとなる可能性がある[34]。
がん
パイロトーシスはさまざまな種類のがんとの関連が示唆されている。主として、パイロトーシスは内因性DAMPの存在下でがん細胞を殺し、腫瘍の発生を阻害する。一部のケースでは、GSDMDはがんの予後マーカーとして利用される。一方で、炎症性因子の産生の持続は腫瘍の成長に好都合な微小環境の形成を促進する可能性もある[35]。パイロトーシスの機構を理解し、関連する分子を同定することは、さまざまながんの治療に有用である可能性がある。
胃がん細胞では、GSDMDの存在によってサイクリンA2/CDK2複合体は阻害され、細胞周期の停止、そして腫瘍成長の阻害が引き起こされる。また、胃がん細胞が特定の化学療法薬によって処理された場合には、GSDMEの細胞内濃度が上昇する。GSDMEはその後カスパーゼ-3を活性化し、パイロトーシスによる細胞死を開始させる[17]。
子宮頸がんはヒトパピローマウイルス(HPV)の感染によって引き起こされる場合がある。AIM2タンパク質は細胞質中のウイルスDNAを認識してAIM2インフラマソームを形成し、カスパーゼ-1依存的な古典的パイロトーシス経路を開始する。HPVの感染はSIRT1タンパク質のアップレギュレーションを引き起こし、SIRT1はAIM2の転写因子となるRELBをダウンレギュレーションする。SIRT1のノックダウンによってAIM2の発現はアップレギュレーションされ、パイロトーシスが開始される[36]。
代謝異常
NLRP3インフラマソームやカスパーゼ-1の発現レベルは、肥満や2型糖尿病など、いくつかのメタボリックシンドロームの重症度と直接的に関係している。IL-1βやIL-18の産生レベルはカスパーゼ-1の活性によって影響され、これらのサイトカインによってインスリンの分泌は損なわれる。その後グルコースの取り込みレベルは低下し、インスリン抵抗性として知られる状態となる[37]。インスリン抵抗性はIL-1βによって誘発される膵β細胞の破壊によってさらに加速される[38]。
クリオピリノパチー
インフラマソームをコードする遺伝子の変異は、クリオピリノパチー(cryopyrinopathy)と呼ばれる自己炎症性疾患群の原因となる。この疾患群にはMuckle-Wells症候群、寒冷自己炎症性症候群、CINCA症候群などが含まれ、全て急な発熱と限局的な炎症という症状を示す[39]。こうした症例で変異が生じている遺伝子の1つがNLRP3であり、インフラマソームの過剰な活性化とIL-1βの過剰産生が引き起こされる。こうした変異は機能獲得型(gain-of-function)変異と呼ばれる[40]。
HIVとAIDS
カスパーゼ-1を介したパイロトーシスはHIVによるCD4+T細胞の枯渇と炎症を駆動していることが示されており[3][41][42][43]、これら2つの特徴的なイベントはAIDSへの進行を推進する。パイロトーシスは細胞内の複製ニッチを除去し、炎症性サイトカインと内因性danger signalの放出によって防御応答を高めることで、迅速に感染を制限し除去する能力に寄与しているが、HIVによって引き出されるような病理的な炎症においては、この有益な応答で刺激の根絶に至ることはない。事実、細胞死を起こしているCD4+T細胞が放出する炎症シグナルはさらに多くの細胞を感染リンパ組織へ誘引し、さらなる細胞死と慢性炎症、組織損傷が引き起こされる負の病原性サイクルが形成されているようである。この病原性サイクルは安全かつ効果的なカスパーゼ-1阻害薬によって遮断されうる。こうした医薬品は、ウイルスではなく宿主を治療標的とする、HIV感染患者に対する新たな抗AIDS治療薬となる可能性がある。カスパーゼ-1欠損マウスは正常に発生することからも[44][45]、カスパーゼ-1の阻害が有害ではなく有益な治療効果をもたらすことが考えられる。
Remove ads
出典
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads