トップQs
タイムライン
チャット
視点
促進拡散
ウィキペディアから
Remove ads
促進拡散(英: Facilitated diffusion)、促進輸送(英: Facilitated transport)または受動的媒介輸送(英: Passive-mediated transport)とは、分子やイオンが特定の膜貫通型蛋白質を介して生体膜を通過する自発的受動輸送(能動輸送の対語)の過程を指す[1]。受動的であるため、促進輸送はATPの加水分解による化学エネルギーを必要とせず、分子やイオンは拡散の原理に従って低濃度側へ移動する。
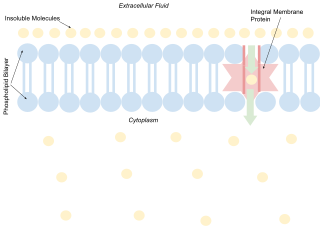
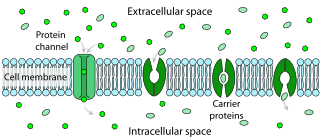
促進拡散と単純拡散にはいくつかの相違点が認められる:
- 促進拡散は、被拡散物と細胞膜に埋め込まれたチャネルまたは膜貫通型蛋白質との間の分子間結合に依存している。
- 促進拡散の速度は、2相(細胞膜内外)間の濃度差に対して飽和する。一方単純拡散の速度は濃度差に対して線形である。
- 分子間結合のプロセスが存在するため、促進輸送の温度依存性は単純拡散とは大きく異なる[2]。単純拡散の温度依存性は穏やかである。
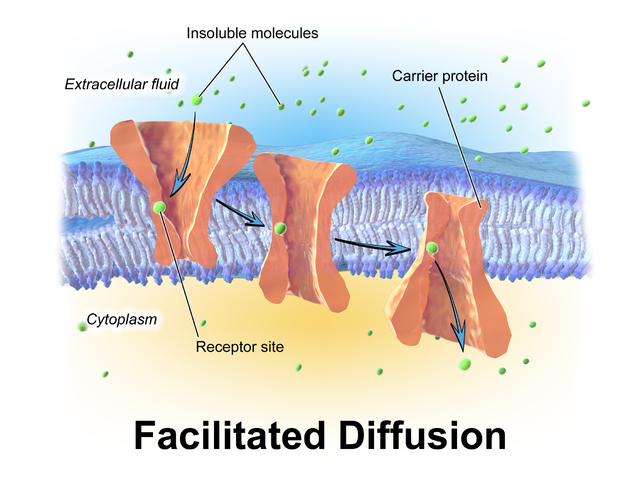
脂質二重層を構成するリン脂質の脂肪酸末端は疎水性であるため、水溶性の極性分子や大きなイオンは細胞膜を自由に拡散できない。酸素や二酸化炭素のような小さな無極性分子だけが、膜を横切って容易に拡散できる。小さな極性分子は膜透過チャネルによって輸送される。これらのチャネルはゲート機能を持ち、開閉することで時には浸透圧勾配に逆らって、膜を横切るイオンや小さな極性分子の流れを調節する。より大きな分子はペルメアーゼのような膜貫通型蛋白質によって輸送され、輸送の際に立体配座が変化する(グルコースやアミノ酸など)。レチノールや脂質のような非極性分子は水に溶けにくく、これらは水溶性の担体(レチノール結合蛋白質など)により細胞の水性区画や細胞外腔を通って輸送される。拡散促進にはエネルギーを必要としないため、代謝物は変化しない。代謝物を輸送するために形状を変えるのはペルメアーゼのみである。代謝物の変化を伴う細胞膜間輸送は、官能基転移輸送(group translocation transportation)と呼ばれる。
グルコース、ナトリウムイオン、塩化物イオンなどは細胞膜を効率良く横断しなければならないが、細胞膜の脂質二重層は事実上不透過性であるので、これらの輸送は膜を横断し代替経路やバイパス機構を提供する蛋白質によって“促進”されなければならない。このプロセスを媒介する蛋白質の例としては、グルコース輸送体、有機陽イオン輸送蛋白質、尿素輸送体、モノカルボン酸輸送体8、モノカルボン酸輸送体10などがある。
Remove ads
促進拡散のin vivoモデル
物理的・生化学的プロセスの多くは拡散によって制御されている[3]。拡散促進は拡散の一形態であり、幾つかの代謝プロセスにおいて重要である。拡散促進は、転写因子(TF)がDNA分子上の指定された標的部位に結合する際の主なメカニズムである。in vitroモデルは生細胞の外で起こる促進拡散の方法として非常によく知られており、細胞質基質内の3次元拡散パターンとDNA鎖に沿った1次元拡散を説明する[4]。細胞外で起こるプロセスについて広範な研究が行われてこのメカニズムは一般的に受け入れられたが、このメカニズムが生体内または生細胞の内部で起こり得ることを検証する必要があった。そこでBauerとMetzler[4]は細菌ゲノムを用いた実験を行い、TF-DNA結合が起こるまでの平均時間を調査した。TFがバクテリアのDNA鎖と細胞質を横切って拡散するのにかかる時間を分析した結果、DNAへのTFの結合とDNAからのTFの解離の速度はどちらも同様であるという点で、in vitroとin vivoでは類似しているという結論に達した。また、DNA上では動きが遅いが標的部位を特定しやすい一方、細胞質内では動きは速いがTFの標的に対する感受性が低いため結合が制限されることが示された。
細胞内促進拡散
1分子イメージング[注 1]は、生きた細胞における転写因子の結合メカニズムの研究に必要な理想的な解像度を提供するイメージング技術である[6]。大腸菌のような原核細菌の細胞では、制御蛋白質がDNA塩基対上の標的部位を見つけて結合するために、拡散が促進されることが必要である[7][6][8]。それは主に、1.蛋白質がDNA上の非特異的な部位に結合する、2.標的部位を見つけるまでDNA鎖に沿って拡散(英: sliding)する、の2段階からなる[7]。蛋白質がスライディングする過程で、蛋白質は3次元と1次元の拡散パターンを使ってDNA鎖の全長を探索する[9]。
3次元拡散の際、夾雑蛋白質[注 2]の出現率が高いため高浸透圧が生じ、探索蛋白質(lac転写抑制因子など)がDNA鎖に近づき、吸引力が増して結合できるようになる。また立体効果により、この領域(Lacオペレーター領域)から夾雑蛋白質が排除される。抑制蛋白質は1次元拡散にのみ関与する。則ち、DNA鎖に沿って結合・拡散し、細胞質内では拡散しない。
Remove ads
クロマチン上での蛋白質の拡散促進
上述のin vivoモデルは、3次元拡散およびDNA鎖に沿った1次元拡散と鎖上の標的部位への蛋白質の結合を明解に説明する。原核細胞と同様に真核生物においても促進拡散は染色質フィラメント上の核質内で発生し、蛋白質が核糸[注 3]に結合している場合と核質内で自由に拡散している場合のダイナミクスの切り替えによって説明される[10]。更に、染色質分子が断片化されていることを考慮すると、そのフラクタル特性を考慮する必要がある。染色質のフラクタル構造上で3次元拡散相と1次元拡散相を交互に繰り返しながら標的蛋白質の探索に要する時間を計算した結果、真核生物では拡散が促進されることで探索過程が促進され、DNA鎖と蛋白質の親和性が高まることで探索時間が最小化される旨が推論された[10]。
酸素の促進拡散
赤血球表面のヘモグロビンと酸素との高親和性は、その結合能力を高くする[11]。酸素の促進拡散系では、酸素というリガンドと、ヘモグロビンまたはミオグロビンという担体との間に密接な関係がある[12][13]。酸素の促進拡散は酸素圧を比較的制御できる均質な環境で発生する[14][15]。酸素の拡散が起こるためには、膜の片側が完全飽和圧(より高い)であり、もう片側が完全低圧[訳語疑問点](より低い)でなければならず、即ち膜の片側がより高酸素濃度でなければならない。促進拡散ではヘモグロビンは酸素の定常拡散速度を増加させ、促進拡散はオキシヘモグロビン分子がランダムに移動するときに起こる。
一酸化炭素の場合
一酸化炭素の促進拡散は酸素の拡散と同様に進行する。一酸化炭素もヘモグロビンやミオグロビンと結合するが[15]、解離速度は酸素の1⁄100である。ミオグロビンに対する親和性は、酸素に比べて40倍、ヘモグロビンでは250倍高い[16]。
グルコースの促進拡散
グルコースは分子が大きいため膜を通過する拡散は困難であり[17]、促進拡散によって膜を横切って濃度勾配を下り拡散する。膜輸送体蛋白質はグルコースと結合し、グルコースが輸送されやすいようにその形状を変化させる[18]。グルコースの細胞内への移動は、膜を貫通する蛋白質の数によって速く/遅くなる。グルコースは、細胞内の他のグルコース分子に駆動力を与える依存性グルコース共輸送体によって濃度勾配に逆らって輸送される。促進拡散は、毛細血管に隣接する細胞外空間への蓄積グルコースの放出に寄与している[18]。
関連項目
脚注
外部リンク
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads
