トップQs
タイムライン
チャット
視点
膜孔形成毒素
ウィキペディアから
Remove ads
膜孔形成毒素(まくこうけいせいどくそ、英: Pore-Forming Toxin、略称: PFT)とは、生物によって生合成されて外分泌される毒素の中で、細胞膜を貫通する細孔を形成することで、標的細胞を障害、あるいは、死に追いやるタンパク質である。細菌の他に、ミミズなどによっても産生されており、様々な種類の膜孔形成毒素が知られている。

種類
PFTは細胞膜上に膜貫通チャネルを形成するが、その構造はαヘリックスかβバレルかのどちらかに依存する[1] 。
- α型膜孔形成毒素(α-PFT)
- 溶血素Eファミリー、アクチノポリン、Escherichia coli由来細胞溶解素A
- βバレル型膜孔形成毒素(β-PFT)
- α溶血素(図1)、パントンバレンタインロイコシジン(Panton-Valentine leukocidin: PVL)、種々の殺虫毒素
そのほかの分類方法
- 2成分性毒素
- 炭疽毒素
- コレストロール依存性細胞溶解素 (CDCs)
- ニューモリシン
- 低分子膜孔形成毒素
βバレル型膜孔形成毒素
要約
視点
β-PFTはほぼβストランドベースのドメインで構成されており、β-PFT単量体が集合してβバレル多量体を形成する。ロイコシジン、Etx-Mtx2、エロリジンなどの多くのタンパク質ファミリーの多様な配列を含む。X線結晶構造解析によると、α溶血素[2]とパントンバレンタインロイコシジン[3] の構造は関連している。同様に、エロリジン[4]とクロストリジウムε毒素[5]とMtx2はEtx/Mtx2ファミリーと関連する[6]。
β-PFTには、害虫の防除に商業的に可能性のある化学物質が多い。これらの毒素は強力で、かつ限られた範囲の標的昆虫に対してのみ高度に特異的であり、安全な防虫剤として活用できる。
Etx/Mtx2ファミリーの殺虫性物質には、ヒト疾患の媒介となる蚊を防除できるLysinibacillus sphaericus由来のMtx2とMtx3[7] 、ならびに、農業上の害虫防除に有益なBacillus thuringiensis 由来のCry15、Cry23、Cry33、Cry38、Cry45、Cry51、Cry60およびCry74がある[8] 。
Toxin-10ファミリーの殺虫性毒素は、エロリジンとEtx/Mtx2毒素と全体的な構造に類似性を示すが、特徴は異なる。これらの毒素はすべて、頭部ドメインとより大きな尾部ドメインを特徴とする。尾部ドメインは、伸長したβシートで構成される。Toxin_10タンパク質の頭部ドメインは、レクチンのような、炭水化物結合ドメインの特徴を示す。Toxin_10タンパク質の、唯一報告されている自然界の標的は昆虫である。Cry36 [9]とCry78[10]を除いて、Toxin_10毒素は2成分毒素として作用すると見られている。Toxin_10タンパク質のBinAおよびBinBは共に、Lysinibacillus sphaericusのBin殺蚊性毒素で作用する[11]。Toxin_10 Cry49は、イエカ属(Culex)蚊幼虫に対するその活性についてCry48と共依存する[12] 。そしてBacillus thuringiensis Toxin_10タンパク質Cry35は、aegerolysinファミリーCry34と相互作用してWestern corn Rootwormを殺す[13]。この毒素のペアは、SmartStaxコーンなどの昆虫抵抗性植物に含有されている。
作用機序

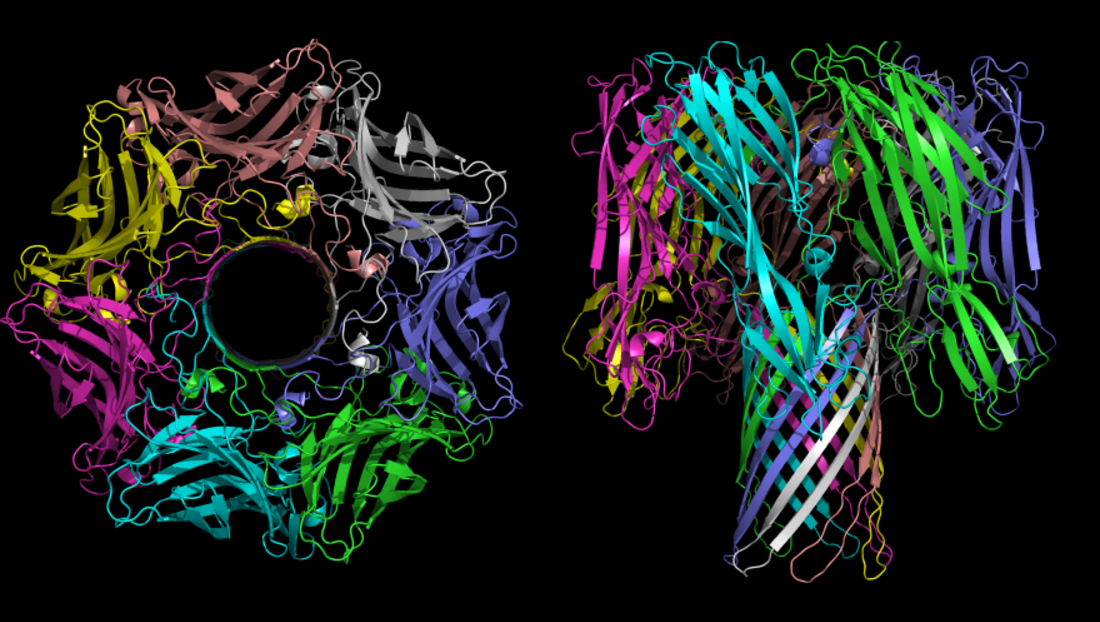
β-PFTは最初、水溶性単量体として存在し、標的細胞膜上で集合して多量体となり膜孔を構成するタンパク質である。図1は、最初に同定された膜孔形態のβ-PFTの結晶構造であるα溶血素の細孔形態を示す。キノコの笠は細胞の外側表面に位置取り、キノコの茎は細胞膜を貫通する通路となり、細胞膜を透過性に変える。キノコの茎は、各モノマーから2本の鎖が供与された14ストランドのβバレルから成る。
膜孔形態のコレラ菌(Vibrio cholerae)細胞溶解素の構造もまた7量体である[14][15]。黄色ブドウ球菌(Staphylococcus aureus)γ溶血素は八量体構造と16本ストランドの茎を形成する[16][17] 。
パントンバレンタインロイコシジンSの膜孔形態はα溶血素と高度に関連した構造を示すが、水溶性単量体形態では、茎を形成するストランドの立体配座が大きく異なる[18][19] (図2)。
Lysinibacillus sphaericusのBin toxinは人工膜[20]および蚊の培養細胞[21]に膜孔を形成することができるが、リサイクリングエンドソームにおける毒素の取り込みおよび大型のオートファゴソームの生成などの他の一連の細胞変化をも引き起こす[22]。このことから、Bin toxinによる細胞死の原因はアポトーシスである可能性がある[23]。同様の細胞毒性は他のToxin_10ファミリー毒素にも見られる[24][25]。
集合機構
β-PFTの水溶性モノマーと膜結合プロトマーはオリゴマー形成の際、コレステロール依存性細胞溶解素(Cholesterol-dependent cytolysin: CDC)と同じように、まず最初に細胞表面上に(ある場合にはレセプター媒介様式で)会合してプレポア状態となる。これに続いて、膜貫通部が形成されて膜に挿入される大規模な構造変化が起こる。膜に挿入される部分は頭部と呼ばれ、通常、無極性で疎水性であり、挿入がエネルギー的に有利となるようにする[1]。と言うのも、細胞膜の基本構造は脂質二重層によって形成されており、細胞膜の内側と外側の表面は親水性であるのに対して、細胞膜の内部は疎水性であるため、細胞膜を貫通する部分については疎水性の方がなじみやすいためである。
特異性
クロストリジウムε毒素やウェルシュ菌エンテロトキシン(Clostridium perfringens enterotoxin: CPE)などの一部のβ-PFTは、特定の受容体を介して細胞膜に結合する[26] 。これらの受容体は毒素の局所的な濃度増加を促進し、 オリゴマー化および膜孔形成を可能にする。
Lysinibacillus sphaericus Bin毒素の特異性はBinB Toxin_10成分によって付与されている。この成分はイエカ属(Culex)[27] およびハマダラカ属(Anopheles)の中腸のGPIアンカー型αグリコシダーゼを特異的に認識するが、ヤブカ属(Aedes)に見られる関連タンパク質は認識しない[28] 。
細胞毒性
膜孔が形成されると、細胞の流入・流出の可能・不可能の厳密な調節が妨げられる。細胞内のイオンや、アミノ酸やヌクレオチドなどの低分子は流出し、周囲の組織から水分子が流入するようになる。細胞内の重要な低分子の損失は、タンパク質合成および他の重要な細胞反応を妨げる。イオン、特にカルシウムイオンの喪失は、細胞シグナル伝達経路を擬似的に活性化または不活性化させる可能性がある。無制御な水分子の細胞への流入は、細胞を制御不能に膨潤させ、blebbingを引き起こし得る。blebbingでは、細胞膜の大部分が歪み内圧で崩壊し、最終的に細胞は破裂する。
Remove ads
2成分毒素
2成分毒素には様々な種類の毒素が存在する。2成分毒素という言葉は、2つの毒素部分が存在し、その両方が毒性活性に必要なものである。いくつかのß-PFTは2成分毒素である。
Toxin_10ファミリータンパク質の大多数は、Toxin_10または他の構造ファミリーのタンパク質と組み合わせて2成分毒素となる。Bacillus thuringiensis由来のCry23/Cry37毒素[29]などの商業上利用されるβシート毒素も2成分毒素である。
酵素的2成分毒素
いくつかの2成分毒素は酵素成分(A成分)と、膜への相互作用および酵素成分の細胞への侵入に関与する成分(B成分)とで構成されている。B成分の一部は、βシート豊富な構造ドメインを有している。酵素的2成分毒素には、炭疽菌の致死毒素や浮腫毒素(炭疽毒素)、ウェルシュ菌ι毒素、クロストリジウム・ディフィシル(Clostridium difficile)細胞毒性毒素などの2成分毒素の以下に例を示す。
B成分は、β‐PFTのようなホモオリゴマー膜孔を形成することによって、酵素成分の標的細胞への侵入を促す。A成分は侵入後、以下の方法で宿主細胞機能を阻害する。
ADPリボース化
ウェルシュ菌イオタ毒素やボツリヌス菌C2毒素等毒素はADPリボース部分をG‐アクチンの表面アルギニン残基177に結合させる。これにより、G-アクチン集合体がF-アクチンの形成を防止され、細胞骨格が破壊され、細胞死が生じる。ADPリボース転移酵素ファミリーには殺虫毒素もあり、リシニバチルス・スフェリカス(Lysinibacillus sphaericus)のMtx1毒素 [30]およびバチルス・チューリンゲンシス(Bacillus thuringiensis)のVip1/Vip2毒素、フォトラブダス属(Photorhabdus)種やゼノラブダス属(Xenorhabdus)種などグラム陰性細菌の毒素複合体(Tc)毒素のいくつかが含まれる。Mtx1タンパク質のベータシートリッチ領域は、糖脂質相互作用に関与可能性のあるレクチン様配列である[31]。
分裂促進因子活性化タンパク質キナーゼキナーゼのタンパク質分解
致死性炭疽毒素のA成分は亜鉛メタロプロテアーゼであり、分裂促進因子活性化タンパク質キナーゼ(MAPK)ファミリーへの特異性を示す。MAPKファミリータンパク質の喪失は細胞シグナル伝達の崩壊をもたらし、免疫応答は誘発されなくなる。
cAMP細胞内濃度の増加
炭疽毒素の浮腫毒素は標的細胞へのカルシウムイオンの流入を引き起こす。これにより、cAMP濃度を増大させる。白血球増殖、食作用および炎症性サイトカイン放出は阻害され、あらゆる種類の免疫応答は異常をきたす。
コレストロール依存性細胞溶解素

肺炎レンサ球菌(Streptococcus pneumoniae)由来のニューモリシンなどのコレストロール依存性細胞溶解素(CDC)は、30–44個の単量体による260 Å(26 nm)の大きな膜孔を形成する[33]。ニューモリシンの各単量体のαヘリックス部分は、α溶血素のような方法で膜貫通する両親媒性βヘアピンにコンフォメーション変化する前に巨大な多量体の表在性膜タンパク質複合体に会合する(図3)。CDCは細孔形成毒素のMACPFファミリーとホモログであり、両ファミリーの作用メカニズムは同じことが示唆されている(図4)[34]。真核生物MACPFタンパク質は免疫防御で機能し、パーフォリンや補体C9などのタンパク質に見出される[35]。
ウェルシュ菌(Clostridium perfringens)由来のパーフリンゴリジンに密接に関連する高度に保存されたコレステロール依存性細胞溶解素のファミリーは、バチルス目細菌によって産生される毒素であり、anthrolysinやalveolysin、sphaericolysinを含む[27]。Sphaericolysinは特定の昆虫に対して毒性を示す[36]。
Remove ads
生物学的機能
毒素の機能と目的の例を以下に示す。
脚注
外部リンク
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads