トップQs
タイムライン
チャット
視点
触媒作用
化学反応 ウィキペディアから
Remove ads
触媒作用(Catalysis)は、触媒(Catalyst)として知られる物質を加えることで[1][2]、化学反応速度が増す現象である。触媒は化学反応により消費されず、反応後も変化せずに残る[3]。反応速度が速く、触媒が迅速に再利用できる場合、非常に少量の触媒で十分なことが多い[4]。反応速度において重要な要素は、混ざり具合、表面積、温度である。一般に、触媒は1つかそれ以上の反応物と反応して反応中間体を作り、その後、触媒を再生しながら最終生成物を作る。


触媒が存在すると、触媒がない場合の反応機構よりずっと速い代替機構で反応することができ、そのため反応が加速する。しかし、触媒がない場合の機構も残ることができ、そのため、合計の速度は触媒が存在するときにのみ加速し、減速することはない[5]。
触媒は、反応物と同じ相(通常は気相か液相)に分散して存在する均一系触媒と、異なる相にある不均一系触媒に分類される。酵素やその他の生体触媒は、しばしば3つ目の分類と考えられる。
触媒は、全ての種類の化学産業で普遍的である[6]。推計によると、商業生産されるすべての化学製品の90%が製造のある段階で触媒を用いる[7]。
英語のCatalystという言葉は、ギリシア語で「緩める」「ほどく」という意味のκαταλύειν, katalueinという言葉に由来する。触媒の概念は、酸化還元実験に関する彼女の新しい研究に基づいて、イギリスの化学者エリザベス・フラムが考案した[8][9]。
Remove ads
原則
要約
視点
例
分かりやすい例として、過酸化水素の水と酸素への分解の速度に対する触媒の効果がある。
- 2 H2O2 → 2 H2O + O2
出発物質よりも生成物の方が安定であるためこの反応は進むが、反応速度が遅いため、過酸化水素溶液は流通が可能である。二酸化マンガン等の触媒が存在すると、この反応はずっと速く進む。この効果は、酸素の発泡として見ることができる[10]。この反応では触媒は消費されず、不変のまま回収することができ、何度も再利用可能である。従って、二酸化マグネシウムはこの反応を触媒していると言われる。生体中では、この反応は、カタラーゼ等の触媒として働くタンパク質である酵素により触媒される。
別の例として、触媒により大気汚染や一酸化炭素量の削減に与える効果がある。一酸化炭素を他の望ましい物質に変換する選択的酵素の開発は、酵素の最も重要な役割の1つである。一酸化炭素を水素化する触媒により、この有毒なガスを除去し、有用な材料を得ることができる[11]。
単位
触媒作用を測定するSI組立単位は、カタールであり、モル毎秒として定量される。触媒の生産性は、
ターンオーバー数(TDN,触媒回転数)と時間当たりのTDNである触媒回転頻度(TOF)で記述できる。生体内では、ユニットがこれに相当する。
触媒反応機構
→詳細は「触媒サイクル」を参照
一般的に、触媒は活性化エネルギーのより低い別の反応機構(反応経路)を提供するため、触媒の存在下では化学反応の速度が上がる。触媒下の反応機構では、触媒は再生される[12][13][14][15]。
気相で起こる反応の例として、2 SO2 + O2 → 2 SO3の反応は、一酸化窒素を加えることで触媒される。この反応は、以下の2段階からなる。
- 2 NO + O2 → 2 NO2(律速)
- NO2 + SO2 → NO + SO3(高速)
一酸化窒素触媒は再生され、全体の反応速度は、遅い段階の反応速度となる[15]。
- v=2k1[NO]2[O2]
不均一系触媒の例として、酸化チタン(IV)の表面上で酸素と水素が反応し、水を生成する反応がある。走査型トンネル顕微鏡では、分子が吸着し、解離する様子が観察される。表面に結合した酸素原子と水素原子が解離すると、一緒に拡散する[16][17]。
中間反応状態では、HO2、H2O2、続いて、H3O2や反応生成物(水二量体)が生成し、その後水分子が触媒表面から脱着する。
反応エネルギー

触媒は、触媒がない状態の反応とは別の反応経路を可能とする。これらの経路は、活性化エネルギーが低く、その結果、より多くの分子衝突が遷移状態に達するのに必要なエネルギーを持つ。そのため触媒は、運動エネルギー障壁のために阻害されたり速度が遅くなる反応を実現することができる。触媒は反応速度や選択性を増し、またはより低い温度での反応を可能とする。この効果は、エネルギープロファイル図で示すことができる。
触媒存在下の素反応では、触媒は反応の範囲を変えず、反応の化学平衡に影響を与えない。反応速度と逆反応速度の比は影響を受けない。熱力学の第二法則は、なぜ触媒が反応の化学平衡を変えないかを記述する。即ち、化学平衡を変化させる触媒が存在すると仮定した場合、その触媒を系に導入すると新しい平衡に移動する反応が起こり、エネルギーが生成する。反応は、ギブス自由エネルギーが生産される場合にのみ自発的であることから、エネルギーの生成は必然の結果であり、エネルギー障壁がなければ触媒を必要としない。さらに、触媒を除去する際にも反応を引き起こし、エネルギーを生成する。そのため、触媒を添加する際と除去する際の両方でエネルギーが生み出されることになり、従って、化学平衡を変化させる触媒の存在は熱力学の法則に矛盾する永久機関となる。従って、触媒は化学平衡を変化させないと言える。ただし、触媒自体が後続の反応の反応物となる場合、平衡定数を変えることがある。この場合、反応物となった触媒は消費される。例として、塩基触媒によるエステルの加水分解の場合、生成したカルボン酸が直ちに塩基触媒と反応し、平衡は加水分解の方に動く。
触媒は、出発物質よりも遷移状態をより安定化させる。出発物質と遷移状態の間のエネルギーの差を小さくし、運動エネルギー障壁を下げる。出発物質と生成物の間のエネルギー差(熱力学的障壁)や、環境中の熱や光で与えられる利用可能なエネルギーを変化させるわけではない。
関連の概念
いわゆる触媒と呼ばれるもののいくつかは、実際はプレ触媒であり、反応によって触媒に変換される。例えば、ウィルキンソン触媒RhCl(PPh3)3は、真の触媒サイクルに入る前に1つのトリフェニルホスフィンリガンドを失う。プレ触媒は保存が容易だが、in situで容易に活性化する。この前活性化段階のため、多くの触媒反応には誘導期が含まれる。
触媒作用を改善する化学種は、補酵素と呼ばれる。
タンデム触媒では、2つかそれ以上の異なる酵素が1度の反応に作用する。
自触媒反応では、触媒は反応全体の生成物である。最も単純な例は、1段階あるいは多段階で、A + B → 2Bとなる種の反応である。反応全体では単にA → Bで、Bが生成物であるが、Bは反応物でもあるので、反応速度式中に現れ、反応速度に影響を与え、実質的に反応は自身で加速する。例として、アスピリン等のエステルをカルボン酸とアルコールに加水分解する反応がある。酸触媒の追加がなければ、生成物のカルボン酸が加水分解を触媒する。
スイッチ触媒は、外部刺激により、異なる反応性を持つ異なる基底状態間で触媒作用を切り替えることができる触媒である[18]。触媒を可逆的に切り替えるこの能力は、触媒活性と選択性に対する空間的及び時間的制御を可能にする。切替に必要な外部刺激には、温度、pH、光[19]、電場、または化学物質の添加等がある。
真の触媒は、犠牲剤と両輪で作用する。真の触媒は素反応で消費され、不活性型になる。犠牲剤は別のサイクルで、真の触媒を再生する。犠牲剤はこの反応で消費され、そのためこれは酵素とは呼ばない。例えば、酸化オスミウム(VIII)は、ジヒドロキシル化のための良い試薬であるが、毒性が非常に高く、高価である。アップジョンジヒドロキシル化では、犠牲剤のN-メチルモルホリン N-オキシドが酸化オスミウム(VIII)を生成し、触媒量の酸化オスミウム(VIII)しか必要としない。
分類
触媒は、反応物と同じ相(通常は気相か液相)に分散して存在する均一系触媒と、異なる相にある不均一系触媒に分類される。酵素やその他の生体触媒は、しばしば3つ目の分類と考えられる。
Remove ads
不均一系触媒
要約
視点


不均一系触媒は、反応物とは異なる相で作用する。不均一系触媒の大部分は固体で、液体又は気体の反応混合物中で作用する。重要な不均一系触媒には、ゼオライト、アルミナ[20]、高次酸化物、グラファイト、遷移金属酸化物、また水素化のためのラネー合金、接触法により二酸化硫黄を三酸化硫黄に酸化する五酸化バナジウム等の金属がある[21]。
吸着の起こり方により、表面での反応の多様な機構が知られている(ラングミュア=ヒンシェルウッド機構、リデアル=エリー機構、マーズ=ファン・クレベレン機構等)[22]。固体の表面積は、反応速度に大きな影響を与える。触媒の粒子が小さいと、粒子の質量当たりの表面積は大きくなる。
不均一系触媒には、物質が結合する原子や結晶面である活性部位が存在する。不均一系触媒の体積の大部分だけでなく、表面の大部分も触媒として不活性である可能性がある。活性部位の性質を明らかにすることは技術的に困難である。
例えば、窒素と水素からアンモニアを合成するハーバー・ボッシュ法の触媒は、しばしば鉄と言われるが、詳細な研究と多数の最適化により、鉄-カリウム-カルシウム-アルミニウム酸化物の混合触媒が開発された[23]。反応ガスは、鉄粒子の活性部位に吸着する。一度物理的に吸着すると、試薬によって部分的又は全体的に解離し、新しい結合を形成する。このようにして、窒素間の強力な三重結合が壊れるが、この反応の活性化エネルギーは非常に高いため、気相では非常に珍しい現象である。反応全体の活性化エネルギーが低下することで、反応速度が増す[24]。不均一触媒が用いられる別の例として、五酸化バナジウム上での二酸化硫黄の酸化による硫酸の生産がある。多くの不均一触媒は、実際にはナノ材料である。
不均一系触媒は通常、二次物質である担体上に分散し、効力の増加と費用の低減を図る。担体は、小さな触媒粒子の凝結や焼結を防ぎ、表面積を広げ、その結果、触媒の特異活性を高める。単にその上で触媒が広がって表面積を増やすだけの担体もあるが、担体と触媒が相互作用し、触媒反応に影響を与えることも多い。各々の触媒分子が化学的に結合する場を与え、ナノ粒子の合成にも用いられる。担体は表面積の多い有孔の物質であり、多くはアルミナ、ゼオライトや様々な活性炭素等である。二酸化ケイ素、二酸化チタン、炭酸カルシウム、硫酸バリウム等の特殊な担体も存在する[25]。
電解触媒
→詳細は「電解触媒」を参照
電気化学、特に燃料電池工学においては、燃料電池を構成する半反応の速度を向上させるために様々な金属含有触媒が用いられる。燃料電池の電解触媒の1つの一般的な例としては、若干大きな炭素粒子を担体とした白金ナノ粒子がある。燃料電池の1つの電極と接触すると、白金触媒は、水、水酸化物、過酸化水素に対する酸素還元の速度を向上させる。
Remove ads
均一系触媒
要約
視点
→詳細は「均一系触媒」を参照
均一系触媒は反応物と同じ相で作用する触媒である。通常、基質とともに溶媒に溶解している。均一系触媒の1つの例として、酢酸とメタノールからの酢酸メチルの合成のような、カルボン酸のエステル化における水素イオンH+の影響がある[26]。均一系触媒を必要とする大量生産プロセスには、ヒドロホルミル化、ヒドロシリル化、ヒドロシアノ化等がある。無機化学者にとって、均一系触媒はしばしば有機金属触媒と同義である[27]。しかし、コバルト塩がp-キシレンをテレフタル酸に変換する触媒になるなど、多くの均一系触媒は有機金属ではない。
有機分子触媒
→詳細は「有機分子触媒」を参照
触媒作用の研究においては、遷移金属が研究対象となることが多いが、金属を含まない有機小分子も触媒としての性質を示し、実際に多くの触媒は遷移金属を含まない。通常、有機触媒は、遷移金属(イオン)触媒と比べて、多くの使用量(反応物の量1単位当たりの触媒の量で、mol%の単位で表される)を必要とするが、これらの触媒は通常大容量で市販されており、費用低減に寄与している。2000年代前半には、これらの有機触媒は「新世代」と考えられ、遷移金属(イオン)触媒と競合するものであった。
有機触媒は、水素結合等の非共有結合性相互作用を利用して、非金属の酵素のように機能すると考えられている。
有機触媒に関する学問分野は、触媒-基質間の結合や相互作用について、共有結合性(例:プロリン及び4-ジメチルアミノピリジン)触媒と非共有結合性(例:チオ尿素)触媒を各々応用したものに分かれる。2021年のノーベル化学賞は、「不斉有機触媒の開発」に対し、ベンジャミン・リストとデイヴィッド・マクミランに与えられた[28]。
光触媒
→詳細は「光触媒」を参照
光触媒は、触媒が光を受けて励起状態に遷移し、それが酸化還元反応を引き起こす現象である[29]。光触媒により、必ず一重項酸素が生成する。光触媒は、色素増感太陽電池の構成部分である。
酵素と生体触媒
→詳細は「酵素反応」を参照
生物学において、酵素は、代謝や異化に用いられるタンパク質の触媒である。大部分の生体触媒は酵素であるが、リボザイムやデオキシリボザイム等のように、他の非タンパク質生体分子も触媒作用を見せることがある[30]。
生体触媒は均一系触媒と不均一系触媒の中間と考えることができるが、厳密には可溶性酵素は均一系触媒、膜結合酵素は不均一系触媒である。
酵素(及び他の触媒)の活性に影響を与える要因には、温度、pH、また酵素、基質及び生成物の濃度等がある。酵素反応に特に重要な物質は水であり、多くの結合形成反応の産物であり、また多くの結合解離反応の反応物である。
酵素は、異性化糖やアクリルアミドを含む多くの汎用化学品の製造に用いられている。
化学反応の遷移状態と似た安定分子に結合するいくつかのモノクローナル抗体は、化学反応の活性化エネルギーを低下させることによって、弱い触媒作用を示すことができる[31]。これらのモノクローナル抗体は、抗体酵素(アブザイム)と呼ばれる。
重要性
要約
視点

市販される全ての化学製品の90%は、製造のいずれかの段階で酵素が用いられていると推定されている。2005年には、触媒により、世界中で約9000億ドルの製品が生み出された[33]。
触媒の関与する分野は非常に広範なため、分野の細分化は容易ではないが、特に注目を集めている分野は、以下のとおりである。
エネルギー生産
石油精製においては、アルキル化、クラッキング(長鎖炭化水素の小片への分解)、ナフサの接触改質、水蒸気改質(炭化水素の合成ガスへの変換)等の多くの工程において触媒を利用する。
化石燃料の燃焼による排気さえも触媒によって処理される。通常、白金とロジウムで構成される三元触媒は、自動車の排気中のより有害な副産物の一部を分解する。
- 2 CO + 2 NO → 2 CO2 + N2
合成燃料の場合、昔からあるが今でも重要な方法として、鉄触媒の水性ガスシフト反応により合成ガスから炭化水素を作るフィッシャー・トロプシュ法がある。サバティエ反応では、二酸化炭素と水からメタンが生成する。バイオディーゼルや関連のバイオ燃料は、無機及び生体触媒の両方の処理を必要とする。
燃料電池は、陽極反応と陰極反応の両方に触媒を必要とする。
触媒ヒーターは、可燃性燃料の供給から火のない熱を生成する。
化学製品

化学製品(バルクケミカル)の大規模合成のいくつかは、しばしば酸素を用いる触媒酸化によって行われる。例として、アンモニアからの硝酸の合成、硫酸製造における接触法による二酸化硫黄から三酸化硫黄への変換、p-キシレンからテレフタル酸の合成、プロピレンまたはプロパンからのアクリル酸の合成、プロパンとアンモニアからのアクリロニトリルの合成等がある[22]。
アンモニアの合成は、最も大規模で最もエネルギー集約型のプロセスの1つである。ハーバー・ボッシュ法では、酸化鉄触媒の下、窒素と水素が結合する[34]。一酸化炭素または二酸化炭素からメタノールが合成できるが、銅-亜鉛触媒の利用が必要である。
エチレン及びプロピレンからのポリマーの形成には、しばしばチーグラー・ナッタ触媒が用いられる。酸-塩基触媒からはポリエステル、ポリアミド、イソシアネートが誘導される。
ファインケミカル
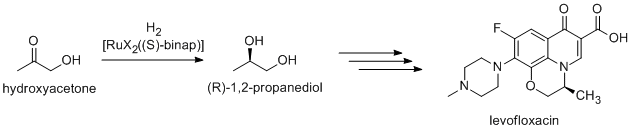
ファインケミカルの多くは、触媒作用によって作られる。方法には、重工業から、規模が大きくなると非常に高価になる専門的の高いプロセスが含まれる。例としては、ヘック反応やフリーデル・クラフツ反応がある。生物活性を持つ化合物の大部分はキラルであるため、多くの医薬品は不斉合成触媒により合成される。合成抗菌薬レボフロキサシンの前駆体である(R)-1,2-プロパンジオールは、野依不斉水素化反応により、BINAP-ルテニウム触媒を用いて、ヒドロキシアセトンから効率的に合成される[35]。
食品生産
触媒利用の最も明らかな応用の1つは、ニッケル触媒により脂肪を水素化し、マーガリンを作ることである[36]。他にも多くの食品が生体触媒により製造されている(下記参照)。
Remove ads
環境
触媒は、工業生産の効率性を挙げることで環境に影響を与えるだけではなく、環境中で直接の役割も持つ。顕著な例としては、オゾン層を破壊する塩素フリーラジカルの触媒がある。これらのラジカルは、クロロフルオロカーボンに紫外線が作用することで形成される。
- Cl· + O3 → ClO· + O2
- ClO· + O· → Cl· + O2
歴史
"catalyst"という用語は、プロセスの速度を増すあらゆる現象と広く定義され、ギリシア語で「無効にする」「ほどく」「拾い上げる」等の意味を持つκαταλύεινという語に由来する。触媒の概念は、酸化還元実験に関する彼女の新しい研究に基づいて、イギリスの化学者エリザベス・フラムが考案し、1794年出版の著書に記載した[8][9][37]。触媒を用いたことが知られる最初の有機化学反応は、デンプンをグルコースに変換する酸触媒を発見したw:Gottlieb Kirchhoffによって1811年に研究された。
"catalyst"という用語は、1835年にイェンス・ベルセリウスが、反応の後も変わらず残る物質により反応が加速される現象に対して用いた[38]。ベルセリウスよりも前の時代のフラムは、還元実験において金属ではなく水を用いていた。他に18世紀に触媒の研究を行っていた化学者には、アイルハルト・ミッチェルリヒ[39]やヨハン・デーベライナー[40][41]がいる。後者は、水素と白金スポンジからなるライターで、1820年代に商業的な成功を収めたデーベライナー・ランプを発明した。ハンフリー・デービーは、触媒としての白金の利用を発見した[42]。1880年代、ライプツィヒ大学のヴィルヘルム・オストヴァルトは、酸や塩基の存在により触媒される反応の系統的研究を開始し、化学反応は有限の速度で進行し、この速度を利用して酸や塩基の強さを決定できることを発見した。この研究により、オストヴァルトは1909年のノーベル化学賞を受賞した[43]。ウラジミール・イパーチェフは、オリゴマー化の発見と商業化、水素化のための触媒の開発を含む、初期の工業規模の反応のいくつかを実施した[44]。
Remove ads
抑制剤、毒、促進剤
添加することで反応速度を低下させる物質は、可逆的であれば反応抑制剤、不可逆的であれば触媒毒と呼ばれる[1]。促進剤は、自身は触媒ではないものの触媒作用を強める物質である[45]。
反応抑制剤は、反応速度を減じるため、「負の触媒」と呼ばれることもある[46]。しかし、活性化エネルギーの高い反応経路を導入するものではないため、反応抑制剤と呼ぶことが好まれる。実際には、これらは、触媒を不活性化させるか、フリーラジカル等の反応中間体を除去することにより作用する[46][12]。不均一系触媒では、コーキングにより副産物のポリマーで被覆することで、触媒作用は阻害される。
抑制剤は、反応速度に加え、選択性にも影響を与える。例えば、アルキンのアルケンへの水素化では、酢酸鉛(II)により部分的に「被毒」したパラジウム触媒(リンドラー触媒)を用いることができる[47]。触媒が非活性化されなければ、生成されたアルケンはさらに水素化されてアルカンになる[48][49]。
抑制剤は、例えば特定のタイプの活性部位のみを選択的に被毒することによってこの効果を発現することができる。また別の機構として、表面を改質し、水素化と水素分解の選択性を変化させるものもある。その他にも多くの機構が可能である。促進剤は、表面を覆ってコーキングの膜の形成を妨げ、また白金上のレニウムのような物質を積極的に除去することができる。また触媒が分散したり、試薬に結合するのを助けることができる。
Remove ads
関連項目
出典
外部リンク
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads
