トップQs
タイムライン
チャット
視点
酸化セシウム
ウィキペディアから
Remove ads
酸化セシウム(さんかセシウム、caesium oxide/cesium oxide)は組成式Cs2Oで表されるセシウムの酸化物である。
セシウムと酸素の二元化合物には数多くのものが知られ、過酸化セシウムCs2O2、超酸化セシウムCsO2、およびオゾン化セシウムCsO3を始めとして、三酸化セシウムCs2O3、Cs11O3、Cs4O、Cs7O、その他、非化学量論的な金属亜酸化物が存在する。しかし通常、酸化セシウムといえば、セシウムイオンCs+と酸化物イオンO2−からなるCs2Oを指す。
Remove ads
製法
要約
視点
金属セシウムを少量の空気と反応させ、過剰の未反応の金属セシウムを蒸留により除いて合成する[4]。
また硝酸セシウムとアジ化セシウムを穏やかに加熱反応させても得られる。
Remove ads
性質
要約
視点
水と熱を発して激しく反応して水酸化セシウムを生成する。無水エタノールとはやや緩慢になるが反応して水酸化セシウムおよびセシウムエトキシドを生成する。
| [3] | |
| [3] | |
真空中で加熱すると350〜400℃で不均化が始まり、過酸化セシウムとセシウムを生ずる。
セシウムのようにイオン半径が大きいアルカリ金属では酸化物より超酸化物の方が熱力学的に安定となるため[5]、空気中での加熱により150℃付近から酸素を吸収して超酸化セシウムを生成する[4]。
Remove ads
構造
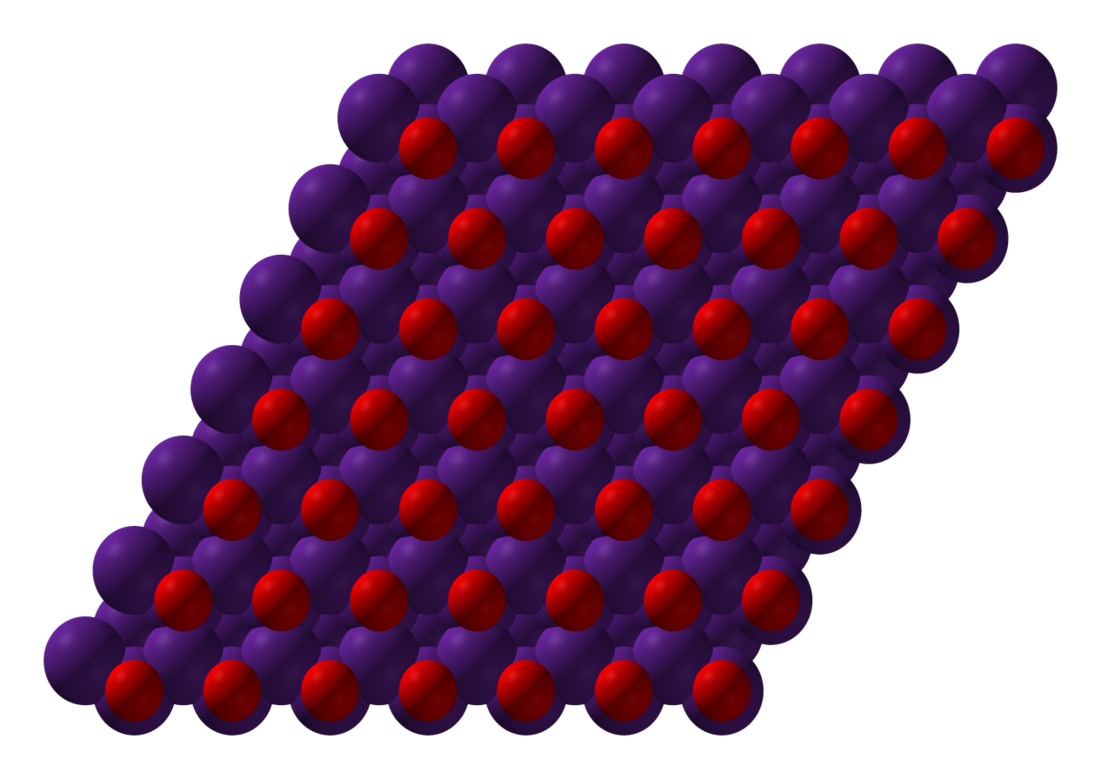
酸化セシウムは他のアルカリ金属酸化物と異なり三方晶系の逆塩化カドミウム型構造をとる。これはセシウムイオンがほぼ面心立方格子構造に配列し、その八面体6配位の間隙の半分を酸化物イオンが占有している。これは面心立方格子構造の3回対称軸に垂直なセシウムイオン層状構造の一つ置きに八面体間隙を酸化物イオンが充填している構造である。 その格子定数はa = 6.79Å、α = 36.5°である[6]。
塩化カドミウム型構造をとる化合物は数多く存在するが、この陰イオンである塩化物イオンサイトに陽イオンが配置した逆塩化カドミウム型構造は既知の化合物中で酸化セシウムが唯一のものである[5]。
用途
脚注
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads




![{\displaystyle {4\,\mathrm {Cs} \ {}+{}\mathrm {O} {\vphantom {A}}_{\smash[{t}]{2}}{}\mathrel {\longrightarrow } {}2\,\mathrm {Cs} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/0487c8b0988255a6bebbf4d0ce4f2945efe34371)
![{\displaystyle {\mathrm {CsNO} {\vphantom {A}}_{\smash[{t}]{3}}\ {}+{}5\,\mathrm {CsN} {\vphantom {A}}_{\smash[{t}]{3}}{}\mathrel {\longrightarrow } {}3\,\mathrm {Cs} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} \ {}+{}8\,\mathrm {N} {\vphantom {A}}_{\smash[{t}]{2}}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/67c74292117243ac48ff0b4168e74a2f265d0ae8)
![{\displaystyle {\mathrm {Cs} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}+{}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}\mathrel {\longrightarrow } {}2\,\mathrm {CsOH} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/034a6fb1b284a6798461b5ea5a55ed6e996ba39c)

![{\displaystyle {\mathrm {Cs} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}+{}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}\mathrel {\longrightarrow } {}2\,\mathrm {Cs} {\vphantom {A}}^{+}{\mskip {2mu}}(\mathrm {aq} ){}+{}2\,\mathrm {OH} {\vphantom {A}}^{-}{\mskip {2mu}}(\mathrm {aq} )}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/2f157a9003f556630b54d9f1a2cc0d0ea65b72fa)

![{\displaystyle {\mathrm {Cs} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}+{}\mathrm {C} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{5}}\mathrm {OH} {}\mathrel {\longrightarrow } {}\mathrm {C} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{5}}\mathrm {OCs} {}+{}\mathrm {CsOH} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/7ce2b2b5fd0f47568bcf2674555f0391cb2ad32a)
![{\displaystyle {2\,\mathrm {Cs} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}\mathrel {\longrightarrow } {}\mathrm {Cs} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {\vphantom {A}}_{\smash[{t}]{2}}\ {}+{}2\,\mathrm {Cs} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/55f1b632e2d80415295da40142c479b818aa0c82)
![{\displaystyle {\mathrm {Cs} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}+{}{\frac {3}{2}}\mathrm {O} {\vphantom {A}}_{\smash[{t}]{2}}{}\mathrel {\longrightarrow } {}2\,\mathrm {CsO} {\vphantom {A}}_{\smash[{t}]{2}}\ {,}{\mkern {3mu}}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/d2e4e9d797c27f87d7d6b3a7d749bb670f9dc664)

