トップQs
タイムライン
チャット
視点
テトラトリコペプチドリピート
ウィキペディアから
Remove ads
テトラトリコペプチドリピート(英: tetratricopeptide repeat、略称: TPR)は、タンパク質中に存在する構造モチーフの1つである。34アミノ酸からなる配列のタンデムリピートから構成され、多様なタンパク質中に同定されている。リピートの数は3個から16個であり[1]、タンパク質間相互作用や、多タンパク質複合体の組み立てのための足場を形成する役割を果たしている。TPRはαヘリックス対の形状をとるリピート配列であり、通常は各リピートが互いに折りたたまれることで、TPRドメインと呼ばれる1本の線形のソレノイドドメインが形成される。こうしたドメインは、後期促進複合体(APC)のサブユニットであるCDC16、CDC23、CDC27、NADPHオキシダーゼのサブユニットであるp67phox、Hsp90結合型イムノフィリン、転写因子、プロテインキナーゼR、ペルオキシソームマトリックスへのタンパク質取り込みの主要な受容体であるPEX5、ミトコンドリアへの取り込みタンパク質などに含まれている。

Remove ads
構造
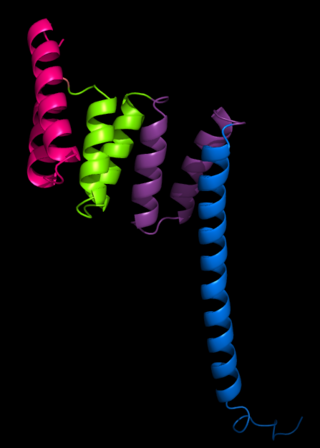
TPRモチーフとして最初に構造決定されたのは、PP5タンパク質である。X線結晶構造解析によって決定された構造では、TPRモチーフが逆平行αヘリックスの対から構成されていることが示された[2]。PP5の構造にはタンデムに並んだ3つのTPRが含まれており、これら一連のTPRによってαヘリックスによるソレノイド構造が形成されていた。
TPRの典型的な構造では、最初のモチーフのヘリックスA、B、そして次のTPRのヘリックスA'との間で相互作用が行われている。こうした相互作用には多少の変化があるものの、一般的にはTPRモチーフの最初の2本のヘリックスはおよそ24°の角度でパッキングしている。TPRモチーフが3つ以上存在する場合には凹面と凸面を有する右巻き超らせん構造が形成され、その凹面がリガンド結合に関与していることが多い[1][3]。

配列の面では、TPRには小さな疎水性残基と大きな疎水性残基が混在しており、完全に不変な残基は存在しない。しかしながら、4番、7番、8番、11番、20番、24番、27番、32番などの残基は保存されていることが多く、これらの中でも8番、20番、24番、27番は保存性が高い。また、特定の残基が保存されているというよりは、小さな残基、大きな残基、芳香族残基といった選択性が存在する。小さな疎水性残基は主にモチーフ内のαヘリックス間相互作用を、大きな疎水性残基は主に隣接するモチーフ間での相互作用を担っている[1]。
Remove ads
TPR含有タンパク質の例
Hop
アダプタータンパク質であるHopは、分子シャペロンHsp70とHsp90との結合を媒介している。Hopには3個のTPRドメインが存在し、そのそれぞれにペプチド結合特異性がみられる。TPR1ドメインはHsp70のC末端を認識することが知られており、TPR2はHsp90のC末端に結合する。Hsp70とHsp90はどちらもC末端はEEVDモチーフで終わり、TPRとの相互作用には静電的なものと疎水的なものの双方が関与している[1][4]。
PEX5
PEX5タンパク質は、ペルオキシソーム標的化配列の1つであるPTS1の受容体となっている。PEX5はTPRモチーフを介してこのシグナル配列と相互作用する。タンパク質のC末端に位置するPTS1との相互作用の大部分は、TPR1、2、3の凹面側表面で行われている[5]。
p67phox
p67phoxは、微生物感染に応答してスーパーオキシドを産生するNADPHオキシダーゼ複合体に必要不可欠なサブユニットである。この複合体の組み立てに重要な段階の1つがRac GTPアーゼの結合であり、このサブユニットのTPRは結合のための足場として機能し、多タンパク質複合体の組み立てを媒介している[6]。
Remove ads
出典
関連文献
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads