상위 질문
타임라인
채팅
관점
브로민화 수소
화합물 위키백과, 무료 백과사전
Remove ads
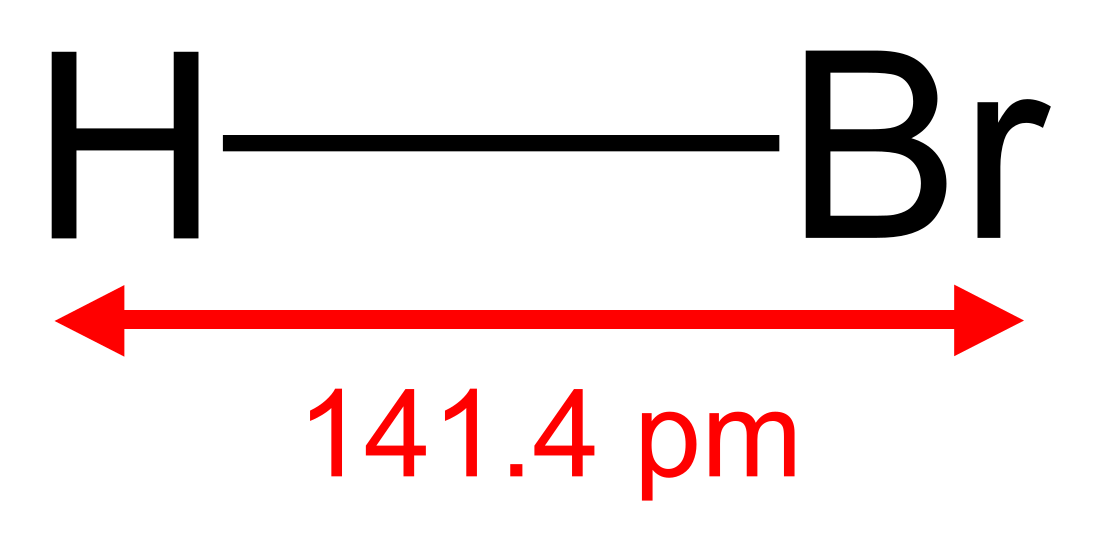
브로민화 수소(영어: hydrogen bromide, HBr)는 상온 상태에서는 무색의 기체이다. 물에 용해하면 브로민화 수소산을 얻게 되고, 반대로 탈수제(脫水劑)의 첨가를 통해 기체를 추출해낼 수도 있지만, 수소산이 용해된 물을 단순히 증류시키는 방법으로는 같은 효과를 기대할 수 없다.
Remove ads
특징
브로민화 수소는 상온 상태에서는 신랄한 냄새가 나는 비휘발성 기체로, 습도 높은 공기와 접촉하면 수소산을 형성하기 시작한다. 물에 잘 녹으며, 298K에서 물에 용해하면 물 중량의 68.85%가 수소산화한 후 포화 상태가 된다. 전체 무게의 47.38%가 용해된 브롬화 수소로 구성된 물은 126 °C에서 끓는 공비 혼합물(azeotropte)이 되는데, 용해된 브로민화 수소의 비율이 더 낮을 경우 H2O는 브로민화 수소의 함유량이 47.38%에 이를 때까지 100 °C에서 계속 증발한다.
용도
브로민화 수소로 알코올에서 브로민화 알킬(alkyl bromide)을 추출한다.
- ROH + HBr → RBr + H2O
알켄에서 분리한 브로민을 첨가해 중요한 유기브로민 화합물(organobromine compound)의 하나인 브로모알케인(bromoalkane)을 이룬다.
- RCH=CH2 + HBr → RCHBr–CH3
알카인에 첨가하여 브로모알켄(bromoalkene)을 생산한다. 입체화학에서는 이런 류의 첨가 반응을 안티(anti)라고 한다.
- RC≡CH + HBr → RCBr=CH2
할로알켄(haloalkene)에 첨가하여 두 브로민 원자가 탄소 원자와 연결된 이중 할로알케인(dihaloalkane)을 만든다. 이런 첨가 반응은 마르코프니코프의 법칙(Markovnikov's rule)을 따른다.
- RCBr=CH2 + HBr → RCBr2–CH3
브로민화 수소는 에폭시 화합물(epoxide)이나 락톤(lactone)을 열거나 브로모아세탈(bromoacetal)을 합성하는 데에도 쓰이고, 촉매 용도로도 사용된다.[8][9][10][11]
Remove ads
공업용 제조
브로민화 수소(브로민화 수소산 포함)는 비슷한 특성을 가진 염화물(chloride)보다 훨씬 더 적은 양이 산출된다. 공업용으로는 수소와 브로민을 200-400 °C에서 대개 백금이나 석면(石綿)을 촉진제로 활용해 제조한다.[9][12]
실험용 합성
브로민화 수소는 여러 방법으로 합성할 수 있다. 편리한 방법의 하나는 브로민화 나트륨(NaBr)과 강산(強酸)을 이용하는 것인데[13], 생성된 브로민화 수소를 다시 산화해버리는 황산은 예외이다.
- 2 NaBr + H2SO4 → 2 Hbr + Na2SO4 과정 도중에 일어나는 2 HBr + H2SO4 → Br2 + SO2 + 2 H2O 반응으로 인해 HBr를 제대로 얻을 수 없다.
브로민화 수소를 산화하지 않는 인산(燐酸) 등은 써도 무방하다.
- 3 NaBr + H3PO4 → 3 Hbr + Na3PO4
테트랄린(tetralin - 1,2,3,4-tetrahydronaphthalene)을 사용하면 이렇게 된다.[13]
- C10H12 + 4 Br2 → C10H8Br4 + 4 HBr
- Br2 + H3PO3 + H2O → H3PO4 + 2 HBr
무수(無水)의 브로민화 수소는 환류하는 자일렌(xylene) 내 트라이페닐포스포늄(triphenylphosphonium)의 열분해(thermal decomposition)를 통해서도 소량을 생산할 수 있다.[8]
위에서 열거한 방법들의 경우 결과물이 브로민 가스(Br2)로 오염되어 있을 수 있는데, 결과가 나온 후 구리로 된 선반이나 페놀 사이로 통과시키면 문제를 해결할 수 있다.[12]
Remove ads
각주
외부 링크
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads