상위 질문
타임라인
채팅
관점
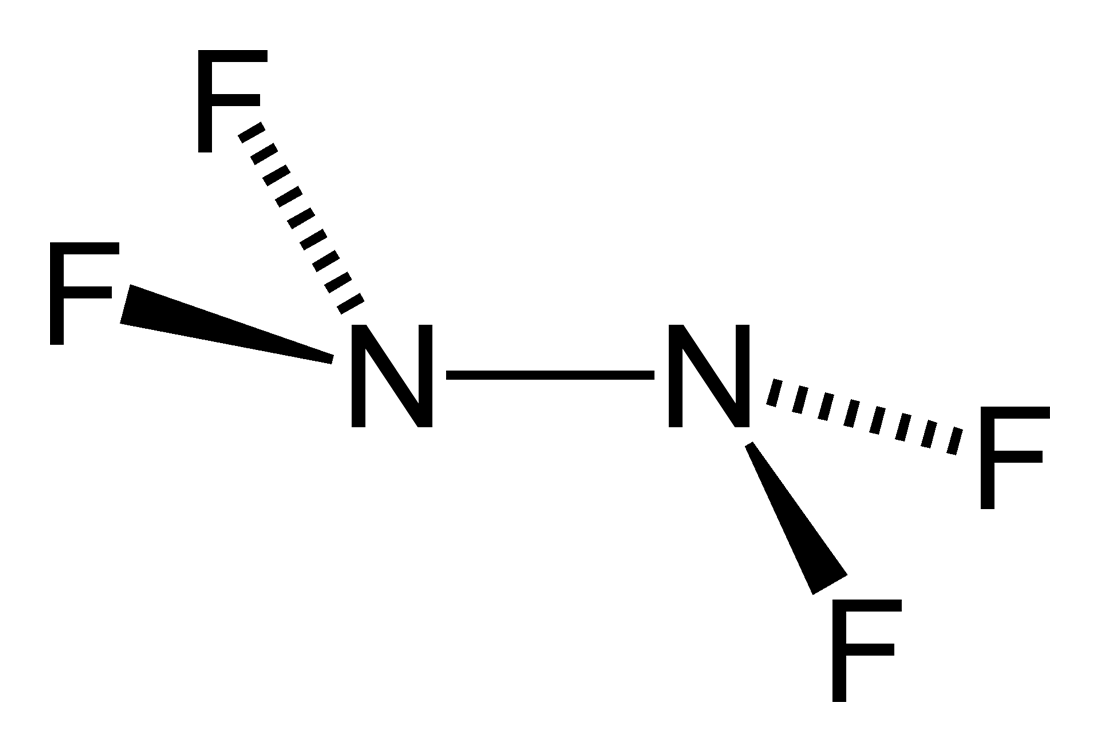
테트라플루오로하이드라진
위키백과, 무료 백과사전
Remove ads
테트라플루오로하이드라진(tetrafluorohydrazine) 또는 퍼플루오로하이드라진(perfluorohydrazine), N
2F
4은 무색의 비가연성[2] 반응성 무기 기체이다. 하이드라진의 플루오르화된 유사체이다.
Remove ads
합성
테트라플루오로하이드라진은 원래 삼플루오린화 질소를 구리 원자를 플루오린 원자 수용체로 사용하여 준비되었다.[3]
- 2NF
3 + Cu → N
2F
4 + CuF
2
탄소, 다른 금속 및 일산화 질소를 포함한 여러 F-원자 수용체를 사용할 수 있다. 이 반응은 NF3의 상대적으로 약한 N-F 결합을 이용한다.[4]
성질
테트라플루오로하이드라진은 라디칼 단량체 이플루오린화 질소와 평형 상태에 있다.[5]
- N
2F
4 ⇌ 2 •NF
2
실온에서 N
2F
4는 대부분 5mm Hg 압력에서 0.7%만이 NF
2 형태로 존재한다. 온도가 225 °C로 상승하면 대부분 해리되어 99%가 NF
2 형태로 존재한다.[6]
N
2F
4의 N-N 결합을 끊는 데 필요한 에너지는 20.8 kcal/mol이며, 엔트로피 변화는 38.6 eu이다.[6] 비교를 위해 N-N 결합의 해리 에너지는 N
2O
4에서 14.6 kcal/mol (61 kJ/mol), N
2O
2에서 10.2 kcal/mol (43 kJ/mol), N
2H
4에서 60 kcal/mol (250 kJ/mol)이다. N
2F
4의 생성 엔탈피 (ΔfH°)는 34.421 kJ/mol이다.[7]
Remove ads
용도
테트라플루오로하이드라진은 유기 합성과 일부 실험적인 로켓 연료 제제에 사용된다.[2] 이중 결합에 첨가되어 인접한 다이(다이플루오르아민)를 생성한다.[8] 화학 합성에서 전구체 또는 촉매로 사용된다. 1959년에는 일부 미사용 로켓 연료 제제에서 고에너지 액체 산화제로 사용될 것으로 고려되었다.[9]
안전성
테트라플루오로하이드라진은 유기 물질과 접촉하면 폭발하는 고위험 화학 물질이다.[2]
피부, 눈 및 폐를 자극하는 독성 화학 물질이다. 신경독이며 메트헤모글로빈혈증을 유발할 수 있다. 흡입하거나 피부를 통해 흡수되면 치명적일 수 있다. 증기는 자극적이고 부식성일 수 있다. 강한 산화제이다. 이 화학 물질과의 접촉은 화상과 심각한 부상을 초래할 수 있다. 화재 시 자극적이고 부식성 있는 독성 가스를 발생시킨다. 액화가스에서 발생하는 증기는 초기에는 공기보다 무거워 지면을 따라 퍼진다.[2]
테트라플루오로하이드라진은 수소, 탄화수소, 알코올, 싸이올, 아민, 암모니아, 하이드라진, 다이시아노젠, 나이트로알케인, 알킬베릴륨, 실레인, 보레인 또는 분말 금속을 포함한 환원제와 실온에서 접촉하면 폭발하거나 발화한다. 테트라플루오로하이드라진 용기가 고온에 장시간 노출되면 격렬하게 파열되고 로켓처럼 발사될 수 있다. 테트라플루오로하이드라진 자체는 고온 또는 압력 하에서 충격이나 폭발로 인해 폭발할 수 있다. 공기 중에서 분해를 위해 가열되면 플루오린과 산화 질소의 고독성 연기를 방출한다.[2]
압력 확인을 위해 밸브를 열다가 실린더가 폭발하여 한 명이 사망하고 다른 한 명이 부상을 입은 치명적인 사례가 있다.[2]
Remove ads
각주
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads