Kalcija fosfāts
ķīmisks savienojums Ca₃P₂O₈ From Wikipedia, the free encyclopedia
Remove ads
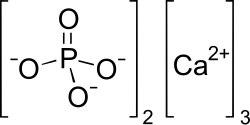
Kalcija fosfāts ir kalcija un fosforskābes sāls ar ķīmisko formulu Ca3(PO4)2. Tas arī zināms, kā tribāziskais kalcija fosfāts un kaļķu kaulu fosfāts. Tā ir balta, mazšķīstoša viela. Lielākā daļa komerciālo "trikalcija fosfāta" paraugu faktiski ir hidroksiapatīts.[1]
Tas eksistē trijās kristāliskajās polimorfajās formās α, α′, un β. α un α′ ir stabilas augstā temperatūrā.
Remove ads
Nomenklatūra
Kalcija fosfāts attiecas uz daudziem materiāliem, kas sastāv no kalcija joniem (Ca2+) kopā ar ortofosfāta (PO43-), metafosfāta vai pirofosfāta (P2O74-) un reizēm ar oksīda un hidroksīda joniem. Jo īpaši parastajam minerālu apatītam ir formula Ca5(PO4)3X, kur X ir F, Cl, OH vai maisījums, tas pārsvarā ir hidroksiapatīts, ja papildu jons galvenokārt ir hidroksīds. Liela daļa tirgū esošā kalcija fosfāta faktiski ir pulverveida hidroksiapatīts.
Remove ads
Sagatavošana
Kalcija fosfātu ražo komerciāli, apstrādājot hidroksiapatītu ar fosforskābi un dzēstiem kaļķiem.
To nevar nogulsnēt tieši no ūdens šķīduma. Parasti tiek izmantotas dubultās sadalīšanās reakcijas, kas ietver šķīstošos fosfātu un kalcija sāļus, piemēram (NH4)2HPO4 + Ca(NO3)2, tiek veiktas kontrolētos pH apstākļos.[2] Nogulsnes būs vai nu amorfs kalcija fosfāts vai kalcija deficīts hidroksiapatīts Ca9(HPO4)(PO4)5(OH).[2][3][4] Kristālisko kalcija fosfātu var iegūt kalcinējot nogulsnes. Parasti veidojas β-Ca3(PO4)2, lai iegūtu α-Ca3(PO4)2, nepieciešama augstāka temperatūra.
Alternatīva mitrajai procedūrai ir kalcija pirofosfāta un kalcija karbonāta karsēšana:[3]
CaCO3 + Ca2P2O7 → Ca3(PO4)2 + CO2
Remove ads
β-, α- un α′- Ca3(PO4)2 polimorfo formu struktūra
Kalcija fosfātam ir 3 polimorfās formas, romboedriskā β forma (parādīta iepriekš) un divas augstas temperatūras formas, monoklīniska α un sešstūra α′. β formas kristalogrāfiskais blīvums ir 3,066 g/cm3, kamēr augstas temperatūras formas ir mazāk blīvas, α formai blīvums ir 2,866 g/cm3 un α′ - 2,702 g/cm3 un visām formām ir sarežģītas struktūras, kas sastāv no tetraedriskiem fosfātu centriem, kas caur skābekli ir saistīti ar kalcija joniem.[5] Augstas temperatūras formām ir divu veidu kolonnas, viena satur tikai kalcija jonus, bet otrā - gan kalcija, gan fosfāta jonus.[6]
Starp β un α formām ir atšķirības ķīmiskajās un bioloģiskajās īpašībās, α forma ir vairāk šķīstoša un bioloģiski noārdāma. Abas formas ir komerciāli pieejamas un tās ir preparātos, kurus izmanto medicīnā un zobārstniecībā.[6]
Atrašanās dabā
Kalcija fosfāts ir viens no galvenajiem kaulu sadegšanas produktiem (kaulu pelni). Kalcija fosfātu parasti iegūst arī no neorganiskajiem avotiem, piemēram, minerāliem.[7] Kalcija fosfāts dabā ir sastopams vairākās formās, ieskaitot:
- iežos Marokā, Izraēlā, Filipīnās, Ēģiptē, un Kolas pussalā (Krievija) un mazākos daudzumos citās valstīs. Dabiskā forma nav pilnīgi tīra, un daži citi komponenti, piemēram, smiltis un kaļķis var mainīt sastāvu. P2O5 saturs fosfāta iežos ir no 30% līdz 40% no masas.
- skleletā un mugurkaulnieku zobos
- pienā.
Remove ads
Divfāzu kalcija fosfāts
Divfāzu kalcija fosfāts sākotnēji ziņots kā kalcija fosfāts, bet rentgendifrakcijas dati parāda, ka materiāls ir divu fāzu maisījums, hidroksiapatīta un β-kalcija fosfāta.[8] Tas ir keramisks.[9] Sagatavošana ietver saķepināšanu, izraisot kalcija deficīta apatīta neatgriezenisku sadalīšanos, ko alternatīvi dēvē nestehiometrisko apatītu vai bāzisko kalcija fosfātu.[10] Piemēram:[11]
- Ca10−δ(PO4)6−δ(HPO4)δ(OH)2−δ → (1−δ) Ca10(PO4)6(OH)2 + 3δ Ca3(PO4)2
β-kalcija fosfāts var saturēt piemaisījumus, piemēram, kalcija pirofosfātu Ca2P2O7 un apatītu. β-kalcija fosfāts ir bioresorbējams. Bionoārdīšanās process ietver β formas ātrāku izšķīšanu, kam seko hidroksiapatīta kristālu eliminācija. β forma nešķīst ķermeņa šķidrumos fizoloģiskā pH līmeni, izšķīdināšanai nepieciešama šūnu aktivitāte, kas rada skābāku vidi (pH).[3]
Remove ads
Izmantošana
Pārtikas piedeva
Kalcija fosfātu izmanto pulverveida garšvielās, kā pretsalipes līdzekli, piemēram, lai novērstu galda sāls salipšanu. Tam ir piešķirts Eiropas pārtikas piedevas numurs E341.
Veselības un skaistumkopšanas produkti
Tas ir arī bērnu pulverī, antacīdos un zobu pastā. Zobu pastas, kas satur funkcionalizētu β-kalcija fosfātu, var palīdzēt remineralizēt zobu emalju.[12][13][14]
Biomedicīna
To lieto arī kā uztura bagātinātāju un dabīgi ir sastopams govs pienā, lai gan visizplatītākie un lētākie uztura bagātinātāji ir kalcija karbonāts, kurš jālieto kopā ar ēdienu un kalcija citrāts, kuru var lietot bez ēdiena.[15][16] Ir dažas debates par dažādo kalcija sāļu atšķirīgo biopieejamību.
To var izmantot kā audu aizstājēju kaulu defektu labošanai, ja autogēnā kaulu transplantācija nav iespējama.[17][18][19] To var lietot vienu pašu vai kombinācijā ar bioloģiski noārdāmu, resorbējamu polimēru, piemēram, poliglikolskābi.[20] To var kombinēt ar autologiem materiāliem kaulu transplantācijai.[21][22]
Porainas β-kalcija fosfāta sastatnes tiek izmantotas kā zālu nesējsistēmas vietējai zāļu ievadīšanai kaulos.[23]
Remove ads
Atrašanās dabā
Kalcija fosfāts dabā ir sastopams minerāla tuīta veidā dažos meteorītos. Tā veidošanas ir saistīta ar triecienmetamorfismu.[24]
Atsauces
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads