Mangāna(VII) oksīds
ķīmisks savienojums From Wikipedia, the free encyclopedia
Remove ads
Mangāna(VII) oksīds jeb mangāna heptoksīds ir neorganiska viela ar ķīmisko formulu Mn2O7. Tas ir gaistošs, ķīmiski aktīvs šķidrums. Tas ir bīstams oksidētājs un pirmo reizi tika aprakstīts 1860. gadā.[1] Mangāna(VII) oksīds pieder pie skābajiem oksīdiem un ir nestabilās permangānskābes anhidrīds.
Remove ads
Īpašības
Kristāliskā veidā mangāna(VII) oksīds ir tumši zaļš, bet istabas temperatūrā tas veido šķidrumu, kas ir zaļš atspīdumā un sarkans caurejošā gaismā. Tas šķīst tetrahlorogleklī, bet kontaktā ar ūdeni reaģē, veidojot permangānskābi:
- Mn2O7 + H2O → 2HMnO4
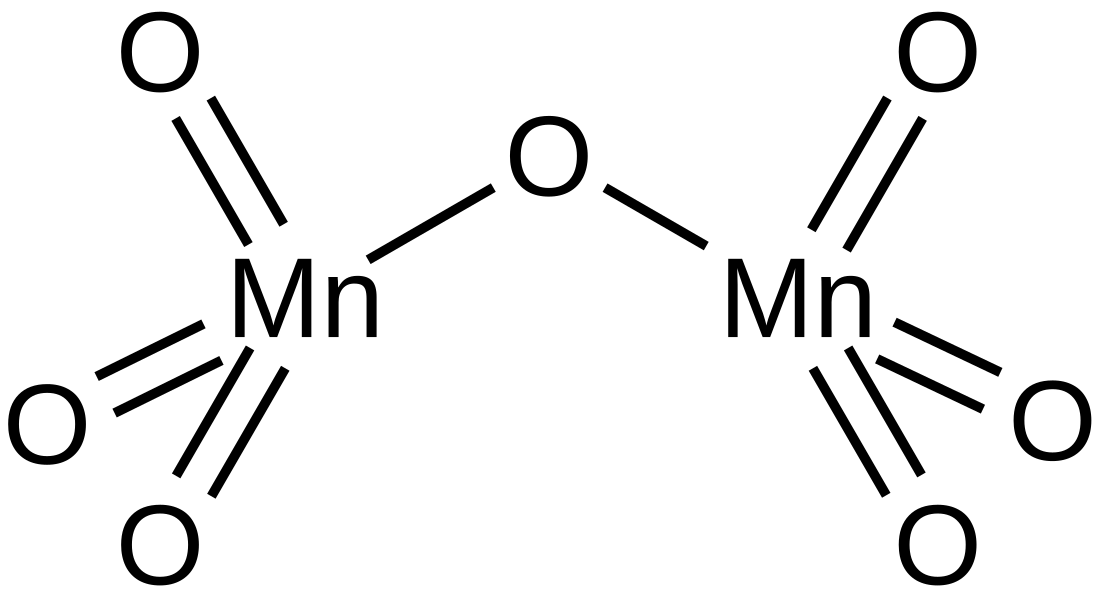
Mangāna heptoksīda kušanas temperatūra ir tikai 5,9 °C, bet tas sāk sublimēties jau pie −10 °C. Šīs īpašības liecina, ka vielas molekula ir nepolāra, kas sakrīt arī ar molekulas uzbūvi. Mn2O7 molekula sastāv no diviem tetraedriem, kuriem viena virsotne ir kopīga. Visās virsotnēs ir skābekļa atomi, bet tetraedru centros ir mangāna atomi.
Mangāna heptoksīdā mangāns ir augstākajā oksidācijas pakāpē +7, tāpat kā permanganātos, kuri ir daudz stabilāki.
Pirosulfātiem, pirofosfātiem un dihromātiem struktūra ir līdzīga kā Mn2O7. Iespējams, vislīdzīgākā struktūra ir hlora(VII) oksīdam Cl2O7.
Mn2O7 ar sprādzienu sadalās tuvu istabas temperatūrai — pie 55 °C. Sprādziens var tikt panākts ar triecienu, vai pievienojot vielai oksidējamu organisku materiālu. Sadaloties rodas MnO2 un O2.[2] Rodas arī ozons, kas reakcijas produktiem piešķir spēcīgu smaku. Ozons var pēkšņi aizdedzināt papīra gabalu, kas iemērkts spirtā.
Mangāna heptoksīds ir bīstama eksplozīva viela, un ar to jārīkojas uzmanīgi! |
Remove ads
Iegūšana
Mn2O7 rodas kā zaļgana, eļļaina viela, reaģējot KMnO4 un koncentrētai sērskābei. Reakcijā rodas permangānskābe HMnO4, kas tiek dehidrēta ar sērskābes palīdzību, veidoties tās anhidrīdam Mn2O7:
- 2KMnO4 + 2H2SO4 → Mn2O7 + H2O + 2KHSO4
Ārējās saites
Atsauces
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads