ਰਸਾਇਣਕ ਸਮੀਕਰਨ
From Wikipedia, the free encyclopedia
Remove ads
ਰਸਾਇਣਕ ਸਮੀਕਰਨ ਜਾਂ ਰਸਾਇਣਕ ਤੁੱਲਕਰਨ ਕਿਸੇ ਰਸਾਇਣਕ ਕਿਰਿਆ ਦਾ ਨਿਸ਼ਾਨੀਆ ਵੇਰਵਾ ਹੁੰਦਾ ਹੈ ਜਿਸ ਵਿੱਚ ਕਿਰਿਆ ਕਰ ਰਹੀਆਂ ਇਕਾਈਆਂ ਨੂੰ ਖੱਬੇ ਪਾਸੇ ਅਤੇ ਕਿਰਿਆ ਸਦਕਾ ਬਣੀਆਂ ਇਕਾਈਆਂ ਨੂੰ ਸੱਜੇ ਪਾਸੇ ਲਿਖਿਆ ਜਾਂਦਾ ਹੈ।[1]ਪਿਹਲੀ ਰਸਾਇਣਕ ਸਮੀਕਰਨ ਜੀਨ ਬਿਗਣ ਨੇ 1615 ਵਿੱਚ ਤਿਆਰ ਕੀਤੀ ਸੀ।
ਕਿਸਮ
ਇੱਕ ਰਸਾਇਣਕ ਸਮੀਕਰਨ ਪ੍ਰਤੀਕਿਰਿਆ ਕਰਨ ਵਾਲੇ ਤੱਤਾਂ ਦੇ ਰਸਾਇਣਕ ਫਾਰਮੂਲੇ ਅਤੇ ਇਸਦੇ ਨਤੀਜੇ ਦੇ ਰਸਾਇਣਕ ਫਾਰਮੂਲੇ ਤੋਂ ਬਣੀ ਹੁੰਦੀ ਹੈ। ਇਹ ਦੋਨੋ ਹਿੱਸੇ ਇੱਕ ਤੀਰ ਦੇ ਨਿਸ਼ਾਨ ( ਨਾਲ ਅਲੱਗ ਕੀਤੇ ਹੁੰਦੇ ਹਨ। ਅਤੇ ਦੋਨੋ ਪਾਸਿਆਂ ਦੇ ਤੱਤਾਂ ਨੂੰ ਇੱਕ ਜੋੜ (+) ਦੇ ਨਿਸ਼ਾਨ ਨਾਲ ਅਲੱਗ ਕੀਤਾ ਹੁੰਦਾ ਹੈ।
ਇੱਕ ਉਦਾਹਰਨ, ਹਾਈਡ੍ਰੋਕਲੋਰਿਕ ਐਸਿਡ ਅਤੇ ਸੋਡੀਅਮ ਦੀ ਪ੍ਰਤੀਕਿਰਿਆ ਦੀ ਸਮੀਕਰਨ ਇਸ ਤਰਾਂ ਹੁੰਦੀ ਹੈ:
- 2 HCl + 2 Na → 2 NaCl + H
2
ਇਸ ਸਮੀਕਰਨ ਨੂੰ ਇਸ ਤਰਾਂ ਪੜਿਆ ਜਾਂਦਾ ਹੈ: ਦੋਂ ਹਾਈਡ੍ਰੋਕਲੋਰਿਕ ਐਸਿਡ ਅਤੇ ਦੋ ਸੋਡੀਅਮ ਦੇ ਦੋ ਐਟਮ ਮਿਲਕੇ ਦੋ ਸੋਡੀਅਮ ਕਲੋਰਾਈਡ ਅਤੇ ਹਾਈਡਰੋਜਨ ਦੋ ਦਾ ਨਤੀਜਾ ਪੈਦਾ ਕਰਦੇ ਹਨ। ਇਸ ਤਰਾਂ ਦੀ ਸਮੀਕਰਨ ਨੂੰ ਸਿੰਗਲ ਡਿਸਪਲੇਸਮੈਂਟ ਸਮੀਕਰਨ ਵੀ ਕਿਹਾ ਜਾਂਦਾ ਹੈ।
Remove ads
ਆਮ ਚਿੰਨ
- "" ਇਹ ਚਿੰਨ ਇੱਕ ਸਟੋਈਕਿਉਸਟਰਿਕ ਸੰਬੰਧ ਲਈ ਵਰਤਿਆ ਜਾਂਦਾ ਹੈ।
- "" ਇਹ ਚਿੰਨ ਅੱਗੇ ਨੂੰ ਵਧਣ ਵਾਲੀ ਪ੍ਰਤੀਕਿਰੀਆ ਨੂੰ ਦਰਸਾਉਣ ਦੇ ਲਈ ਹੈ।
- "" ਇਹ ਚਿੰਨ ਦੋਨੋਂ ਪਾਸਿਆਂ ਵਿੱਚ ਪ੍ਰਤੀਕਿਰੀਆ ਹੋ ਰਹੀ ਹੈ, ਨੂੰ ਦਰਸਾਉਣ ਦੇ ਲਈ ਹੈ
- "" ਇਹ ਚਿੰਨ ਇੱਕ ਸੰਤੁਲਿਤ ਸਮੀਕਰਨ ਦੇ ਲਈ ਵਰਤਿਆ ਜਾਂਦਾ ਹੈ।
Remove ads
ਸੰਤੁਲਿਤ ਰਸਾਇਣਕ ਸਮੀਕਰਨ
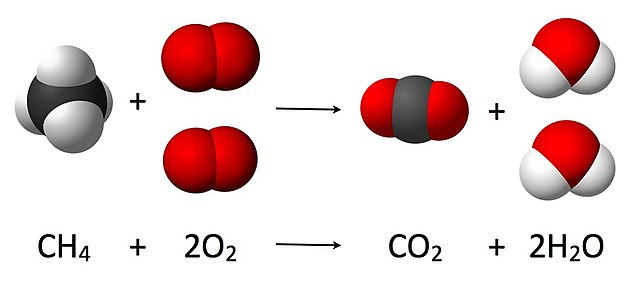
4 + 2 O
2 → CO
2 + 2 H
2O, ਪ੍ਰਤੀਕਿਰਿਆ ਹੋਣ ਵਾਲੇ ਪਾਸੇ ਆਕਸੀਜਨ ਦੇ ਸਾਹਮਣੇ 2 ਲਗਿਆ ਹੈ ਅਤੇ ਇਹਨਾਂ ਦੇ ਨਤੀਜੇ ਦੇ ਵਿੱਚ ਵੀ ਪਾਣੀ ਦੇ ਫਾਰਮੂਲੇ ਸਾਹਮਣੇ 2 ਲਗਿਆ ਹੈ, ਇਸ ਤਰਾਂ ਇੱਕ ਸੰਤੁਲਿਤ ਸਮੀਕਰਨ ਬਣਾਈ ਜਾਂਦੀ ਹੈ। ਭਾਰ ਦੀ ਸੰਭਾਲ ਵਾਲੇ ਕਾਨੂੰਨ ਅਨੁਸਾਰ ਦੋਨੋ ਪਾਸਿਆਂ ਵਿੱਚ ਐਟਮਾਂ ਦੀ ਸੰਖਿਆ ਸਮਾਨ ਹੋਣੀ ਚਾਹੀਦੀ ਹੈ।

ਇਹ ਸਮੀਕਰਨ ਸੰਤੁਲਿਤ ਇਸ ਤਰਾਂ ਕੀਤੀ ਜਾ ਰਹੀ ਹੈ: ਪਿਹਲਾਂ H3PO4 ਨੂੰ P ਐਟਮਾਂ ਨਾਲ ਰਲਣ ਲਈ 4 ਨਾਲ ਗੁਣਾ ਕੀਤਾ ਗਿਆ, ਅਤੇ ਫਿਰ H2O ਨੂੰ H ਅਤੇ O ਦੇ ਐਟਮਾਂ ਨਾਲ ਰਲਣ ਲਈ 6 ਨਾਲ ਗੁਣਾਂ ਕੀਤਾ ਗਿਆ।
ਭਾਰ ਦੇ ਸੰਭਾਲ ਦੇ ਕਾਨੂੰਨ ਦੇ ਅਨੁਸਾਰ ਇੱਕ ਰਸਾਇਣਕ ਸਮੀਕਰਨ ਵਿਚ ਪ੍ਰਤੀਕਿਰਿਆ ਕਰਨ ਵਾਲੇ ਤੱਤਾਂ ਦਾ ਭਾਰ ਅਤੇ ਓਹਨਾਂ ਦੇ ਨਤੀਜੇ ਦੇ ਤੱਤਾਂ ਦਾ ਭਾਰ ਸਮਾਨ ਹੋਣਾ ਚਾਹਿਦਾ ਹੈ। ਇਸ ਕਾਨੂੰਨ ਨੂੰ ਇੱਕ ਰਸਾਇਣਕ ਸਮੀਕਰਨ ਵਿੱਚ ਵੀ ਲਾਗੂ ਕੀਤਾ ਜਾਂਦਾ ਹੈ। ਦੋਨੋਂ ਪਾਸਿਆਂ ਦੇ ਐਟਮ ਸਮਾਨ ਹੋਣੇ ਚਾਹੀਦੇ ਹਨ। ਇਸ ਤਰਾਂ ਨਾਲ ਹੀ ਇੱਕ ਸੰਤੁਲਿਤ ਰਸਾਇਣਕ ਸਮੀਕਰਨ ਬਣਦੀ ਹੈ।
ਸਮੀਕਰਨ ਨੂੰ ਸੰਤੁਲਿਤ ਕਰਨ ਤੋਂ ਪਿਹਲਾਂ ਦੋਨੋ ਪਾਸਿਆਂ ਦੇ ਤੱਤਾਂ ਦੇ ਉੱਤੇ ਇੱਕ-ਇੱਕ ਡੱਬਾ ਬਣਾ ਲਵੋਂ ਜਿਸ ਨਾਲ ਤੁਸੀਂ ਇਹਨਾਂ ਨੂੰ ਸੰਤੁਲਿਤ ਕਰਦੇ ਵਕਤ ਉਲਜੋ ਕੇ ਕੇ ਨਹੀ, ਯਾਦ ਰਖੋ ਕਿ ਡਬ੍ਬੇ ਦੇ ਅੰਦਰ ਕੋਈ ਛੇੜ-ਖਾਣੀ ਨਾ ਕਰੋ, ਉਸਦੇ ਬਾਹਰ ਹੀ ਸਾਰਾ ਕੁਝ ਕਰਨਾ ਹੈ। ਇਸ ਦੇ ਨਾਲ ਤੁਸੀਂ ਸਮੀਕਰਨ ਨੂੰ ਜਲਦ ਸੰਤੁਲਿਤ ਕਰਨਾ ਸਿੱਖ ਜਾਵੋਗੇ ਅਤੇ ਗਲਤੀਆਂ ਵੀ ਘੱਟ ਜਾਣਗੀਆਂ।
ਇੱਕ ਉਦਾਹਰਨ ਵਜੋਂ, ਉਪਰੋਕਤ ਤਸਵੀਰ ਵਿੱਚ ਦਿਸ ਰਿਹਾ ਹੈ, ਮੀਥੇਨ ਦੀ ਜਲਨ ਦੀ ਪ੍ਰਤੀਕਿਰਿਆ ਨੂੰ ਸੰਤੁਲਿਤ ਕਰਨ ਦੇ ਲਈ CH4: ਦੇ ਸਾਹਮਣੇ 1 ਲਗਾ ਦਿੱਤਾ ਜਾਂਦਾ ਹੈ
- 1 CH4 + O2 → CO2 + H2O
ਇਹ ਦਿੱਸ ਰਿਹਾ ਹੈ ਕੀ ਦੋਨੋ ਪਾਸਿਆ ਵਿੱਚ ਕਾਰਬਨ ਦੀ ਸੰਖਿਆ ਇੱਕੋ ਜਿਹੀ ਹੈ, ਇਸ ਲੈ ਇਸਨੂੰ ਸੰਤੁਲਿਤ ਕਰਨ ਦੀ ਕੋਈ ਲੋੜ ਨਹੀ ਹੈ,
ਹੁਣ ਹਾਈਡਰੋਜਨ ਵੱਲ ਵੇਖਿਆ ਜਾਵੇ ਤਾਂ ਖੱਬੇ ਪੱਸੇ ਇਸਦੇ 4 ਆਇਟਮ ਹਨ, ਬਲਕਿ ਸੱਜੇ ਪਾਸੇ ਸਿਰਫ 2 ਹੀ ਹਨ। ਇਸਨੂੰ ਸੰਤੁਲਿਤ ਕਰਨ ਦੇ ਲਈ ਆਪਾਂ H2O ਦੇ ਸਾਹਮਣੇ 2 ਲਗਾ ਦੇਵਾਂ ਗੇ, ਜੋ ਕੀ ਕੁਝ ਇਸ ਤਰੀਕੇ ਨਾਲ ਦਿਸਦਾ ਹੈ:
- 1 CH4 + O2 → CO2 + 2 H2O
ਹੁਣ ਦੁਆਰਾ ਤੋਂ ਚੈੱਕ ਕੀਤਾ ਜਾਵੇ ਤਾਂ ਦੇਖਣ ਨੂੰ ਇਹ ਮਿਲਦਾ ਹੈ ਕਿ ਆਕਸੀਜਨ ਦੇ ਖੱਬੇ ਪਾਸੇ ਸਿਰਫ 2 ਐਟਮ ਹਨ ਅਤੇ ਸੱਜੇ ਪਾਸੇ ਚਾਰ ਹਨ, ਇਸਨੂੰ ਸੰਤੁਲਿਤ ਕਰਨ ਦੇ ਆਪਾਂ ਖੱਬੇ ਪਾਸੇ O2 ਦੇ ਸਾਹਮਣੇ 2 ਲਗਾ ਦੇਵਾਂ ਗੇ, ਜਿਸ ਨਾਲ ਸਾਨੂੰ ਇੱਕ ਸੰਤੁਲਿਤ ਸਮੀਕਰਨ ਮਿਲ ਜਾਵੇਗੀ:
- CH4 + 2 O2 → CO2 + 2 H2O
ਇਸ ਸਮੀਕਰਨ ਵਿੱਚ CH4 ਅਤੇ CO2 ਦੇ ਸਾਹਮਣੇ 1 ਦੇ ਬਜਾਏ ਕੁਝ ਵੀ ਨਹੀ ਹੈ, ਇਸ ਲਈ ਆਪਾਂ 1 ਨੂੰ ਨਹੀ ਦਰਸ਼ਾਵਾਂਗੇ।
ਹਵਾਲੇ
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads



