Najlepsze pytania
Chronologia
Czat
Perspektywa
Teoria kwasów i zasad Brønsteda
Z Wikipedii, wolnej encyklopedii
Remove ads
Teoria Brønsteda (także teoria Brønsteda-Lowry'ego, teoria kwasów i zasad Brønsteda) − teoria, która została sformułowana w 1923 roku niezależnie od siebie przez Johannesa Brønsteda i Thomasa Martina Lowry'ego[1][2], w myśl której kwasem jest substancja mogąca odłączać ze swojej cząsteczki jon wodorowy (proton), natomiast zasadą substancja, która przyłącza protony. Stąd kwas jest donorem protonu (protonodonorem), a zasada akceptorem protonu (protonoakceptorem). Kwas po odłączeniu protonu staje się sprzężoną zasadą, natomiast zasada pobierając proton staje się sprzężonym kwasem:
- kwas + zasada ⇌ sprzężona zasada + sprzężony kwas

3COOH oraz H
3O+
, zaś zasadami CH
3COO−
oraz H
2O.
Ogólny zapis równowagi kwasowo-zasadowej według teorii Brønsteda można przedstawić następująco:
- HA + B ⇌ A− + HB+
gdzie:
- HA − kwas
- B − zasada
- A− − sprzężona zasada
- HB+ − sprzężony kwas
Przykłady:
Remove ads
Amfiprotyczność
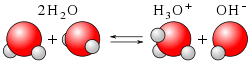
Ponadto, zgodnie z teorią Brønsteda, podczas autodysocjacji wody każda z cząsteczek H
2O może być zarówno donorem, jak i akceptorem protonu:
- H
2O + H
2O ⇌ H
3O+
+ OH−
− woda zachowuje się zarówno jak kwas, jak i zasada, czyli jest związkiem amfoterycznym, dokładniej amfiprotycznym.
Autodysocjacji ulega też wiele innych rozpuszczalników protonowych i stosuje się dla nich analogiczną interpretację w kontekście teorii kwasów i zasad Brønsteda[3].
Im silniejszy jest kwas tym słabsza jest sprzężona z nim zasada[4].
Remove ads
Zobacz też
Przypisy
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads