Лучшие вопросы
Таймлайн
Чат
Перспективы
Аллотропия углерода
Из Википедии, свободной энциклопедии
Remove ads
Углерод — вещество с самым[1] большим числом аллотропических модификаций (более 9 обнаруженных на данный момент).
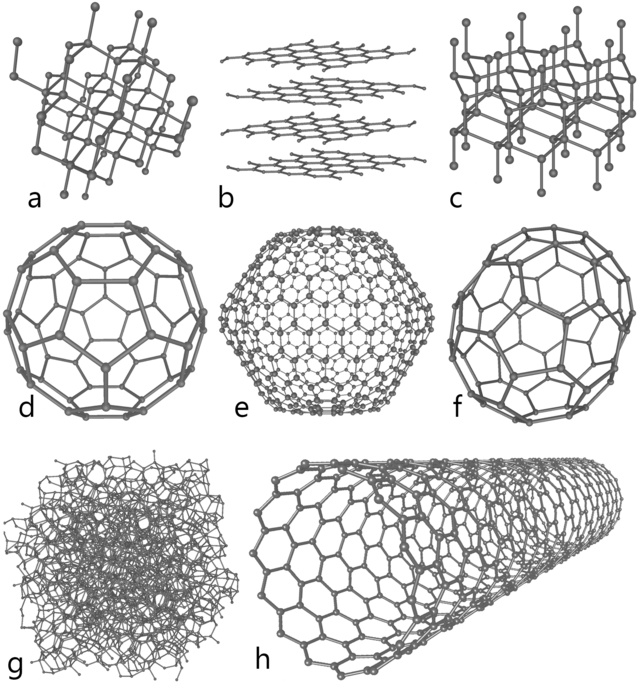
a) Алмаз,
b) Графит,
c) Лонсдейлит,
d) C60 (фуллерены),
e) C540,
f) C70,
g) Аморфный углерод,
h) Однослойная углеродная нанотрубка.
Аллотропные модификации углерода по своим свойствам наиболее радикально отличаются друг от друга, от мягкого к твёрдому, непрозрачного к прозрачному, абразивного к смазочному, недорогого к дорогому. Эти аллотропы включают аморфные аллотропы углерода (уголь, сажа), нанопена, кристаллические аллотропы — нанотрубка, алмаз, фуллерены, графит, лонсдейлит.
Remove ads
Классификация
Классификация аллотропов углерода по характеру химической связи между атомами:
- sp3 формы:
- Алмаз (куб)
- Лонсдейлит (гексагональный алмаз)
- sp2 формы
- sp формы:
- Смешанные sp3/sp2 формы:
- Аморфный углерод (сажа)
- Углеродные нанопочки
- Углеродная нанопена
- Q-Углерод
- Смешанные sp2/sp формы:
- Другие формы: C1 — C2 — C3 — C8
Remove ads
Алмаз
Суммиров вкратце
Перспектива
Алмаз является одним из наиболее известных аллотропов углерода, чья твёрдость и высокая степень рассеивания света делает его полезным в промышленном применении и в ювелирных изделиях. Алмаз — самый твёрдый известный природный минерал, что делает его отличным абразивом и позволяет использовать для шлифовки и полировки. В природной среде нет ни одного известного вещества, способного поцарапать даже мельчайший фрагмент алмаза.
Рынок алмазов промышленного класса несколько отличен от рынков других драгоценных камней. Используемые в промышленности алмазы ценятся главным образом за их твёрдость и теплопроводность, из-за чего другие геммологические характеристики алмазов, в том числе чистота и цвет, по большей части излишни. Это помогает объяснить, почему 80 % добываемых алмазов (что эквивалентно примерно 100 млн. каратам или 20000 кг в год), непригодно для использования в качестве драгоценных камней и известны как борт, предназначенные для промышленного использования. В дополнение к добываемым алмазам, находят промышленное применение и искусственные синтетические алмазы, используемые практически сразу же после их изобретения в 1950 г., а ещё 400 миллионов каратов (80000 кг) синтетических алмазов выпускаются ежегодно для промышленного использования — почти в четыре раза больше массы природных алмазов, добытых за тот же период.
Основным промышленным применением алмазов является резка, сверление (в наконечниках свёрл и буров), шлифовка (резка алмазными гранями) и полировка. Большинство используемых в этих технологиях алмазов не требует крупных образцов; фактически, большинство алмазов качества драгоценных камней, могут использоваться в промышленности. Алмазы вставляются в наконечники буров или режущие кромки пилы или измельчаются в порошок для использования в процессах шлифования и полирования. Специализированное применение включает в себя использование в лабораториях в качестве сдерживающих веществ при экспериментах с высоким давлением, в высокопроизводительных подшипниках и ограниченное применение в специализированных окнах.
С продолжающимся увеличением в производстве синтетических алмазов, их будущее применение становится более осуществимым. Накопление большого запаса — это возможность использовать алмазы в качестве полупроводников при изготовлении микрочипов или использовать для поглощения тепла в электронике. Значительные достижения в исследованиях в Японии, Европе и Соединённых Штатах позволяют использовать возможности, предоставляемые уникальными свойствами алмазного вещества, в сочетании с повышением качества и количества, обеспечиваемыми производителями синтетических алмазов.
Каждый атом углерода в алмазе ковалентен с четырьмя другими атомами углерода в тетраэдре. Эти тетраэдры вместе образуют трёхмерную сеть из слоёв шестичленных колец атомов. Эта устойчивая сеть ковалентных связей и трёхмерное распределение связей является причиной такой твёрдости алмазов.
В ноябре 2017 года ученые SLAC и DESY превратили алмаз в графит посредством мягкого облучения фемтосекундным лазером.
Remove ads
Графит
Суммиров вкратце
Перспектива
Графит (назван Абрахамом Готтлобом Вернером в 1789 г, (с греческого графен — «тянуть/писать», использовался в карандашах) — один из самых обычных аллотропов углерода. Характеризуется гексагональной слоистой структурой. Встречается в природе. Твердость по шкале Мооса 1. Его плотность — 2.3, она меньше чем у алмаза. Приблизительно при 700 °C горит в кислороде, образовывая углекислый газ. По химической активности более реакционен чем алмаз. Это связано с проникновением реагентов между гексагональными слоями атомов углерода в графите. Не взаимодействует с обычными растворителями, кислотами или расплавленными щелочами. Однако, хромовая кислота окисляет его до углекислого газа. Получают нагреванием смеси пека и кокса при 2800 °C; из газообразных углеводородов при 1400—1500 °C при пониженных давлениях с последующим нагреванием образовавшегося пироуглерода при 2500−3000 °C и давлении около 50 МПа с образованием пирографита. В отличие от алмаза, графит обладает электропроводностью и широко применяется в электротехнике. Графит является самой устойчивой формой углерода при стандартных условиях. Поэтому в термохимии он принят за стандартное состояние углерода. Применяется для изготовления плавильных тиглей, футеровочных плит, электродов, нагревательных элементов, твердых смазочных материалов, наполнителя пластмасс, замедлителя нейтронов в ядерных реакторах, стержней карандашей, при высоких температурах и давлениях (более 2000 °C и 5 ГПа) для получения синтетического алмаза.
Порошок графита используется как сухая смазка. Однако в вакууме он заметно теряет смазочные свойства, это связано с тем, что смазочные свойства графита связаны с адсорбрцией воздуха и воды между слоями в графите, в отличие от других слоистых сухих смазок, типа дисульфида молибдена. При большом количестве кристаллографических дефектов, которые связывают слои в структуре, графита, он также теряет смазывающие свойства и становится подобным пиролитическому графиту.
Природные и кристаллические графиты редко используются в чистой форме из-за их скалываемости, хрупкости и противоречивых механических свойств.
Его чистые структурно изотропные синтетические формы, как например пиролитический графит и углеродистые графитовые волокна, представляют чрезвычайно прочный, огнеупорный (до 3000 °C) материал, используемый для защиты носовых конусов ракет, в конструкциях сопел твердотопливных двигателей ракеты, высокотемпературных реакторов, тормозных колодок и электрических моторных щеток.
Вспучивающиеся или растяжимые графиты используются в печах нагрева для герметизации её элементов. В процессе нагрева графит вспучивается (расширяется и обжигается) и герметизирует области контакта. Типичная температура начала расширения (область температур) — между 150 и 300 °C. Электропроводность графита связана с делокализацией электронов пи — связей выше и ниже плоскостей расположения атомов углерода. В отличие от алмаза, в котором все четыре внешних электрона каждого атома углерода 'локализованы' между атомами в ковалентной связи, в графите, каждый атом связан ковалентной связью только с 3 из его 4 внешних электронов. Поэтому каждый атом углерода вносит один электрон в делокализованную систему электронов. Эти электроны находятся в зоне проводимости. Однако электропроводность графита ориентирована по поверхности слоев. Поэтому графит проводит электричество по плоскости слоя атомов углерода, но не проводит в направлении под прямым углом к плоскости.
Remove ads
Другие возможные формы
- Чароит — минерал, который, как считают, сформирован под воздействием ударов метеоритов. Он описывается как несколько более твёрдый, чем графит, с отблеском от серого до белого цвета. Тем не менее, существование такого состояния углерода считается спорным.
- Металлический углерод — теоретические исследования показали, что в фазовой диаграмме углерода в области очень высоких давлений есть области, где он металлический [4] Также показано, что в этих условиях углерод может стать сверхпроводящим при очень низкой температуре (4К) [5].
- Диуглерод — метастабильные частицы С2
- M-углерод — моноклинная сверхтвёрдая форма углерода[6][7]
- C8 — кристаллическая фаза С8со структурой углеродного содалита [8].
- Карбин - атомы углерода образуют некие "нити".
- Графин - бензольные кольца, вершины которых соединены двумя и более углеродами, при этом все атомы лежат в одной плоскости, образуя пластину.
Remove ads
См. также
Примечания
Ссылки
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads
