Лучшие вопросы
Таймлайн
Чат
Перспективы
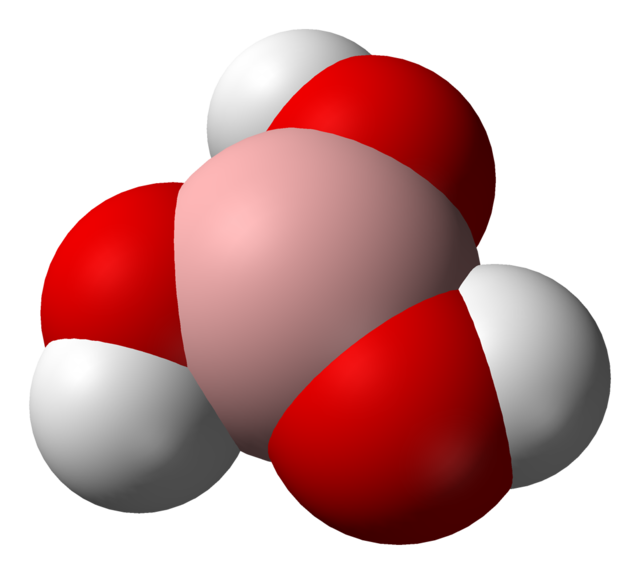
Борная кислота
химическое соединение Из Википедии, свободной энциклопедии
Remove ads
Бо́рная кислота́ (от лат. acidum Boricum, о́ртобо́рная кислота, химическая формула — H3BO3 или B(OH)3) — слабая кислородсодержащая неорганическая кислота, отвечающая высшей степени окисления бора (+3). Бесцветное кристаллическое вещество в виде чешуек, без запаха. Имеет слоистую триклинную решётку, в которой молекулы кислоты соединены водородными связями в плоские слои, слои соединены между собой межмолекулярными связями, длина которых составляет 272 пм.

Впервые была получена немецким химиком Вильгельмом Хомбергом в 1702 году.
Remove ads
История получения
Борная кислота впервые была синтезирована немецким химиком Вильгельмом Хомбергом в 1702 году в результате нагревания минерала буры и железного купороса и последующей многократной очистки полученного летучего вещества сублимацией. Хомберг описал его действие в качестве успокоительного средства и назвал полученное вещество "летучей седативной купоросной солью" (de sel volatile narcotique du vitriol). Название "седативная соль" (ит. sale sedative) надолго закрепилось за данным веществом, состав которого в то время оставался неизвестным[1]:[p. 489] [2] [a]. Антуан Лавуазье[4] и Гитон де Морво[5] ввели для данного соединения термин "борная кислота" (фр. acide borique), отмечая что её остаток, наряду с натрием, входит в состав буры. Состав борной кислоты был установлен в 1808 году вместе с открытием элемента бора независимо в работе Гемфри Дэви[6] и работе Жозефа Луи Гей-Люссака и Луи Жака Тенара[7]. Последние затем в 1811 году получили борную кислоту исходя из бора в результате его реакции горения в кислороде с последующим взаимодействием образующегося оксида бора с водой[8].
Хуберт Франц Хофер обнаружил борную кислоту в составе воды горячих источников Тосканы в 1778 году[9]. В 1799 году Паоло Масканьи открыл минерал сассолин, содержащий борную кислоту[10]. В 1818 году Франсуа де Лардерель открыл первое производство по добыче борной кислоты из природных источников Тосканы[1]:[p. 492].
Remove ads
Нахождение в природе
В природе свободная борная кислота встречается в виде минерала сассолина, в горячих источниках и минеральных водах.
Физические свойства
Борная кислота — это трёхосновная кислота Льюиса, часто используемая в качестве инсектицида, антисептика, огнезащитного состава, поглотителя нейтронов или предшественника для получения иных химических составов.
При нагревании ортоборная кислота теряет воду и сначала переходит в метаборную кислоту, затем в тетраборную H2B4O7. При дальнейшем нагревании обезвоживается до борного ангидрида.
Водные растворы борной кислоты являются смесью полиборных кислот общей формулы Н3m-2nВmО3m-n. В природе встречается в виде минерала сассолина.
Расстояние между соседними слоями — 318 пм.
Химические свойства
Суммиров вкратце
Перспектива
Борная кислота проявляет очень слабые кислотные свойства. Она сравнительно мало растворима в воде. Её кислотные свойства обусловлены не отщеплением катиона Н+, а присоединением гидроксильного аниона:
- Ka = 5,8⋅10−10 моль/л; pKa = 9,24.
Она легко вытесняется из растворов своих солей большинством других кислот. Соли её, называемые боратами, производятся обычно от различных полиборных кислот, чаще всего — тетраборной Н2В4О7, которая является значительно более сильной кислотой, чем ортоборная.
Очень слабые признаки амфотерности B(OH)3 проявляет, образуя малоустойчивый гидросульфат бора В(HSO4)3.
При нейтрализации ортоборной кислоты щелочами в водных растворах не образуются ортобораты, содержащие ион (ВО3)3−, поскольку ортобораты гидролизуются практически полностью, вследствие слишком малой константы образования [В(ОН)4]−. В растворе образуются тетрабораты, метабораты или соли других полиборных кислот:
- Избытком щелочи они могут быть переведены в метабораты:
Мета- и тетрабораты гидролизуются, но в меньшей степени (реакции, обратные приведённым).
В подкисленных водных растворах боратов устанавливаются следующие равновесия:
При нагревании борная кислота растворяет оксиды металлов, образуя соли:
При избытке оксида образуется метаборат кальция:
При недостатке оксида образуется тетраборат кальция:
Взаимодействует с металлами при нагревании:
Термическое разложение борной кислоты происходит в две стадии при медленном нагревании:
Со спиртами в присутствии концентрированной серной кислоты образует эфиры:
- Серная кислота в данном случае отыгрывает роль водоотбирающего средства, и дополнительно протонирует ортоборатную кислоту для разрушения связей между бором и кислородом.
Образование борнометилового эфира В(ОСН3)3 является качественной реакцией на Н3ВО3 и соли борных кислот, при поджигании борнометиловый эфир горит красивым ярко-зелёным пламенем.
Remove ads
Получение
Суммиров вкратце
Перспектива
Борная кислота может быть получена путём смешения буры (тетрабората натрия) с минеральной кислотой, например, соляной:
Является продуктом гидролиза диборана или тригалогенидов бора[11]:
Remove ads
Борная кислота в медицине
Суммиров вкратце
Перспектива
Борный спирт (от лат. Solutio Acidi borici spirituosa) — раствор борной кислоты в этиловом спирте (как правило, в 70 % этаноле).
Спиртовые растворы борной кислоты в концентрации 0,5 %, 1 %, 2 %, 3 %, 5 % готовятся на 70 % этиловом спирте и применяются в качестве антисептика и как противозудное средство при обтирании здоровых участков кожи вокруг очагов пиодермии, а также в качестве ушных капель.
Борная кислота может быть опасна только при бесконтрольном приёме внутрь. Опасная концентрация в организме человека (а особенно ребёнка) может возникнуть при регулярном применении. Смертельная доза при отравлении пероральным приёмом для взрослого человека составляет 15-20 г, для детей — 4-5 г [12].
Борная кислота применяется в медицине с 1860-х годов как антисептическое средство, не раздражающее ран и не имеющее вкуса, запаха и цвета. В современной медицине противомикробная эффективность борной кислоты считается низкой.
Использование борной кислоты в качестве антисептического средства для детей, а также беременных и кормящих женщин было запрещено 2 февраля 1987 года Министерством здравоохранения СССР по рекомендации Фармакологического комитета с формулировкой: «…запретить использование борной кислоты в качестве антисептического средства у детей грудного возраста, а также у женщин в период беременности и лактации в связи с её низкой активностью и высокой токсичностью»[13].
Remove ads
Применение
- В ядерных реакторах в качестве поглотителя нейтронов, растворённого в теплоносителе ядерного реактора.
- Борное удобрение.
- В лабораториях для приготовления буферных растворов.
- В медицине — как самостоятельное дезинфицирующее средство для взрослых, а также в виде 2%-го раствора — для промывки кожи после попадания щелочей.
- На основе борной кислоты производятся различные комбинированные препараты (группа АТХ D08AD), например паста Теймурова.
- В пленочной фотографии — в составе мелкозернистых проявителей и кислых фиксажей для создания слабой кислотной среды.
- В пищевой промышленности зарегистрирована как пищевая добавка E284 (на территории России эта добавка не входит в список разрешённых к применению[14]).
- В ювелирном деле и пр. технике — как компонент флюсов для твердой (высокотемпературной) пайки, например, борная кислота и бура 1:1.
- В литейном производстве — связующее при кислой футеровке печей, компонент защиты струи от окисления при разливке магниевых сплавов.
- В быту — уничтожение тараканов, муравьёв, клопов.
- В производстве керамики, оптоволокна, стекловолокна, стекла[15],
- В качестве антипирена для защиты древесины,
- В составе электролитов для меднения и никелирования.
- Как люминофор или в качестве компонента люминофора для учебных экспериментов по люминесценции веществ.[16][17][18]
Remove ads
Примечания
Литература
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads







![{\displaystyle {\mathsf {B(OH)_{3}+H_{2}O\rightarrow H[B(OH)_{4}]}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/64acca2a47da715749d1c5a357572c40db89e92f)


![{\displaystyle {\mathsf {3H[B(OH)_{4}]\rightleftarrows H^{+}+[B_{3}O_{3}(OH)_{4}]^{-}+5H_{2}O}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/f133f564e3cc3ee790fcc4bd357d169dd359ea94)
![{\displaystyle {\mathsf {[B_{3}O_{3}(OH)_{4}]^{-}+OH^{-}\rightleftarrows [B_{3}O_{3}(OH)_{5}]^{2-}}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/602de5e5f6911e06bb8986fb8cf34a96185c4e61)



![{\displaystyle {\mathsf {H_{3}BO_{3}{\xrightarrow[{}]{107,5^{o}C}}HBO_{2}+\ H_{2}O}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/576fbf0b98e49d69ca0d286cc5502592f1e6c392)
![{\displaystyle {\mathsf {2HBO_{2}{\xrightarrow[{}]{150^{o}C}}B_{2}O_{3}+\ H_{2}O}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/3841155d4f3b212db68d7400f91273e228289e5c)



