Лучшие вопросы
Таймлайн
Чат
Перспективы
Каспаза 3
Из Википедии, свободной энциклопедии
Remove ads
Каспаза 3 (англ. Caspase 3, сокр. CASP3) — протеолитический фермент (КФ 3.4.22.56), одна из каспаз человека, взаимодействует с каспазой 8 и каспазой 9. Кодируется одноимённым геном — CASP3, который локализован на коротком плече (p-плече) 4-й хромосомы. Ортологи CASP3 были идентифицированы у многих видов млекопитающих, для которых имеются полные данные генома. Уникальные ортологи также присутствуют у птиц, ящериц, лиссамфибий и телеостов. Длина полипептидной цепи белка составляет 277 аминокислотных остатков, а молекулярная масса — 31608 Да[4].
Белок CASP3 является членом семейства цистеиновых протеаз, расщепляющих белки исключительно после аспартата[5]. Последовательная активация каспаз играет центральную роль в фазе исполнения клеточного апоптоза. Каспазы существуют в виде неактивных проферментов, которые подвергаются протеолитической обработке в консервативных аспарагиновых остатках с образованием двух субъединиц, больших и малых, которые димеризуются с образованием активного фермента. Димеризованный белок расщепляет и активирует каспазы 6 и 7; и сам белок модифицируется и активируется каспазами 8, 9 и 10. Каспаза 3 является преобладающей каспазой, участвующей в расщеплении белка-предшественника амилоид-бета 4А, который связан с нейрональной смертью, происходящей при болезни Альцгеймера[6]. Альтернативный сплайсинг этого гена приводит к двум вариантам транскрипта, которые кодируют один и тот же белок[7].
 |
 |
Каспаза 3 обладает многими типичными характеристиками, общими для всех известных в настоящее время каспаз. Например, его активный сайт содержит остаток цистеина (Cys-163) и остаток гистидина (His-121), которые стабилизируют расщепление пептидной связи в молекуле белка на С-терминальной стороне аспарагиновой кислоты, когда она является частью специфической 4-аминокислотной последовательностью[9][10]. Эта специфичность позволяет каспазам быть невероятно селективными, с 20000-кратным предпочтением аспарагиновой кислоты по сравнению с глутаминовой кислотой[11]. Ключевой особенностью каспаз в клетке является то, что они присутствуют в виде предшественников (зимогенов), называемых прокаспазами, которые неактивны до тех пор, пока биохимические изменения не вызывают их активацию. Каждая прокаспаза имеет N-концевую большую субъединицу с молекулярной массой около 20 кДа, за которой следует меньшая субъединица с массой около 10 кДа, называемые p20 и p10 соответственно[12].
Remove ads
Субстратная специфичность
В нормальных условиях каспазы распознают тетрапептидные последовательности на своих субстратах и гидролизуют пептидные связи, расположенные после остатков аспарагиновой кислоты. Каспаза 3 и каспаза 7 обладают сходной субстратной специфичностью, распознавая тетрапептидный мотив Asp-x-x-Asp[13]. C-конец аспартата (Asp) имеет абсолютную необходимость, в то время как в других трёх положениях могут быть допущены некоторые изменения[14]. Специфичность к каспазному субстрату широко используется в ингибиторах на основе данных ферментов и разработке лекарственных препаратов[15].
Remove ads
Структура
Каспаза 3 (также известная как CPP32 /Yama/apopain)[16][17][18] образуется из профермента (зимогена) с молекулярной массой 32 кДа, который расщепляется на две субъединицы, с молекулярными массами соответственно 17 кДа и 12 кДа. Когда прокаспаза расщепляется по определённому остатку, активный гетеротетрамер может быть затем образован гидрофобными взаимодействиями, в результате чего четыре антипараллельных бета-листа из p17 и два из p12 соединяются вместе, образуя гетеродимер, который, в свою очередь, взаимодействует с другим гетеродимером, формируя полную 12-элементную структуру бета-листа, окруженную альфа-спиралями, которые являются уникальными для каспаз[12][19]. Когда гетеродимеры совмещаются друг с другом по типу голова-хвост (head-to-tail), активный сайт располагается на каждом конце молекулы, образованной остатками обеих участвующих субъединиц, хотя необходимые аминокислотные остатки Cys-163 и His-121 находятся на p17 (большой) субъединице[19].

Remove ads
Механизм катализа
Каталитический сайт каспазы 3 включает сульфогидрильную группу аминокислотного остатка Cys-163 и имидазольное кольцо His-121. Остаток His-121 стабилизирует карбонильную группу ключевого остатка аспартата, в то время как Cys-163 атакует, в конечном счете, разрывая пептидную связь. Остатки Cys-163 и Gly-238 также функционируют для стабилизации тетраэдрического переходного состояния комплекса субстрат-фермент посредством водородной связи[19]. In vitro было обнаружено, что каспаза 3 предпочитает пептидную последовательность DEVDG (Asp-Glu-Val-Asp-Gly) с расщеплением, происходящим на карбоксильном конце второго остатка аспарагиновой кислоты (между D и G)[11][19][20]. Каспаза 3 активна в широком диапазоне рН, который несколько выше (более основный), чем у многих других каспаз-эффекторов. Данный широкий диапазон указывает на то, что каспаза 3 может быть полностью активна в нормальных и апоптотических условиях[21].

Активация
Суммиров вкратце
Перспектива
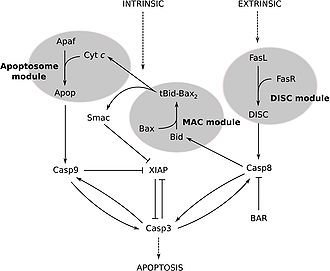
Каспаза 3 активируется в апоптотической клетке как внешним (лигандами смерти), так и внутренним (митохондриальным) путями[12][22]. Отличительной чертой зимогена каспазы 3 является необходимая регуляция, потому что если он не регулируется, активность каспазы приводит к тотальной смерти всех клеток (как здоровых, так и патологических)[23]. Как каспаза-эффектор (экзекутор), зимоген каспазы 3 практически не обладает активностью, пока не происходит его расщепления посредством инициаторной каспазы после того, как произошла передача апоптотического сигнала[24]. Одним из таких сигнальных событий является введение гранзима B цитотоксическими Т-лимфоцитами внутрь клеток, который может активировать инициаторную каспазу[25][26]. Данная внешняя активация затем запускает характерный для апоптотического пути каспазный каскад, в котором каспаза 3 играет доминирующую роль[10]. При внутренней активации каспазы молекулы цитохрома С из митохондрий работают в комбинации с каспазой 9, апоптоз-активирующим фактором 1 (сокр. APAF1), и АТФ необходимой для прокаспазы 3[20][26][27]. Этих молекул достаточно для активации каспазы 3 in vitro, но in vivo необходимы другие регуляторные белки[27]. Было показано, что экстракт мангостана (Garcinia mangostana) ингибирует активацию каспазы 3 в нейрональных клетках человека, обработанных В-амилоидом[28].
Remove ads
Ингибирование
Одним из способов ингибирования каспазы является использование семейства белков IAP (ингибиторов апоптоза), которое включает c-IAP1, c-IAP2, XIAP и ML-IAP[19]. XIAP связывает и ингибирует инициатор каспазы 9, который непосредственно участвует в активации расщепителя каспазы 3[27]. Однако во время каспазного каскада каспаза 3 ингибирует активность XIAP путём расщепления каспазы 9 на конкретном сайте, предотвращая способность связывания XIAP и тем самым ингибировать активность каспазы 9[29].
Remove ads
Биологические функции
Было обнаружено, что каспаза 3 необходима для нормального развития мозга, а также для её типичной роли в процессоре апоптоза, где она отвечает за конденсацию хроматина и фрагментацию ДНК[20]. Повышенные уровни p17 (малых) субъединиц каспазы 3, в кровотоке являются признаком недавнего инфаркта миокарда[30]. В настоящее время показано, что каспаза 3 может играть роль в дифференцировке эмбриональных и гемопоэтических стволовых клеток[31].
Remove ads
Взаимодействие с другими белками
Было показано, что каспаза 3 взаимодействует со следующими белками:
Примечания
См. также
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads




