Лучшие вопросы
Таймлайн
Чат
Перспективы
Координационная геометрия
Из Википедии, свободной энциклопедии
Remove ads
Термин геометрическая координация используется в целом ряде смежных областей химии — химии/физики твердого тела и не только.
Молекулы
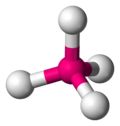
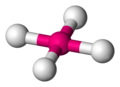
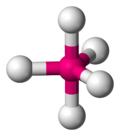
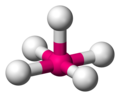
Координационная геометрия атома в геометрическом соединении, образованном атомами вокруг центрального атома.
Координационные комплексы неорганических соединений
Суммиров вкратце
Перспектива
В области неорганических геометрических комплексов координации эти соединения являются геометрическими моделями, образованными атомами лигандов, которые связаны с центральным атомом в молекуле и комплексным соединением. Геометрическое расположение варьируется в зависимости от количества и типа лигандов, связанных с центром, состоящим из металла, а также координационного преимущества (англ. the coordination preference) центрального атома, как правило, металла в координационном комплексе. Число соединений (то есть число σ-связей между центральным атомом и лигандами), называется координационным числом. Геометрическая модель может быть описана как многогранник, где вершины многогранника являются центрами координации атомов лигандов.
Координационное преимущество металла часто варьируется в зависимости от его степени окисления. Число координационных связей (координационное число) может варьироваться от двух до 20.
Одна из самых распространенных геометрических координаций — октаэдрическая, где шесть лигандов координируются к металлу симметричным распределением, что ведет к образованию октаэдра, если линии нарисованы между лигандами. Менее встречающиеся в общей геометрии координации являются формы тетраэдра и «плоского квадрата» (2D квадрат).
Теория кристаллического поля может быть использована для объяснения относительной устойчивости соединений переходных металлов различной геометрической координации, а также наличия или отсутствия парамагнетизма.
ТОЭП может быть использована для предсказания геометрии комплексов основных элементов группы (исключение составляют актиноиды и лантаноиды).
Remove ads
Кристаллографическое использование
Суммиров вкратце
Перспектива
В кристаллической структуре геометрическая модель атома является геометрической структурой координации атомов, где определение координации атомов зависит от связей в модели. Например, в каменной соли, ионный состав каждого атома натрия содержит шесть ближайших соседних хлорид-ионов в октаэдрической геометрии и каждый хлорид аналогично — шесть соседних ионов натрия в октаэдрической геометрии. В металлах с объемноцентрированной структурой каждый атом имеет связь с восмью ближайшими другими атомами с кубической геометрией. В металлах с гранецентрированной кубической структурой каждый атом имеет двенадцать связей с соседними атомами с кубооктаэдрической геометрией.
Где нет дискретных комплексов означает, что соединения найдены как отдельные единицы сфер вокруг атомов в кристаллах
Remove ads
Именование неорганических соединений
ИЮПАК ввел полиэдрический символ (англ. Polyhedral symbol) в части «рекомендации номенклатуры по ИЮПАК в неорганической химии 2005» (англ. IUPAC nomenclature of inorganic chemistry 2005 recommendations) для описания геометрии вокруг атома в соединении.
IUCr (International Union of Crystallography) предложили символ, который показывается как верхний индекс в квадратных скобках в химической формуле. Например, CaF2 будет записан как Ca[8СВ]F2[4T], где [8СВ] означает что это кубическая координация и [4T] означает — четырехгранная. Эквивалентный символ в ИЮПАК обозначается как CU−8 и T-4 соответственно.
Символ ИЮПАК применим к комплексам и молекулам, в то время как по предложению IUCr это относится к кристаллическим твердым телам.
Remove ads
См. также
- Молекулярная геометрия
- Теория поля лигандов
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads