Протон
From Wikipedia, the free encyclopedia
Remove ads
У физици, протон (грч. [ — протос] — „први“) је субатомска честица са позитивним елементарним наелектрисањем од 1,6 × 10−19 кулона и масом од 938 /c2 (1,6726231 × 10−27 kg, што је око 1800 пута већа од масе електрона).[4] Протон се генерално сматра стабилном честицом, са доњом границом полураспада од око 1035 година, и није сигурно да ли уопште може да се распадне. Пошто се не зна да постоји неки физички закон због ког протон не би могао да се распадне, неке данашње теорије предвиђају стабилност, а неке распад протона.[5]
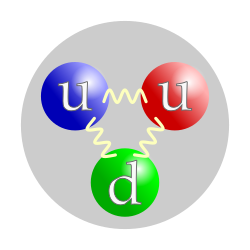
Протон, попут неутрона, спада у нуклеоне, односно честице које сачињавају језгра атома. Атомско језгро најраспрострањенијег изотопа водоника чини само један протон. Језгра других атома се састоје из протона и неутрона које на окупу држи јака нуклеарна сила. Број протона у језгру дефинише хемијски елемент и одређује хемијска својства атома. Протон на основу своје унутрашње структуре спада у класу бариона и састоји се од два Up ("горња") кварка и једног Down ("доњег") кварка, који се на окупу држе јаким нуклеарним силама преко глуона. Античестица протона је антипротон, који као честица има све карактеристике исте као и протон, осим што му је наелектрисање супротног знака, односно има јединично негативно наелектрисање (као електрон). У хемији и биохемији, термин протон може да се односи на водоников јон. У овом контексту, донор протона је киселина, а акцептор протона је база.
Реч протон је изведена из грчке речи са значењем „први”, а ово име је језгру водоника дао Ернест Радерфорд 1920. Претходних година, Радерфорд је открио да водониково језгро (познато да је најлакше језгро) може да се извади из језгара азота атомским сударима.[6] Протони су, према томе, били кандидат за фундаменталну честицу, а самим тим и градивни блок азота и свих других тежих атомских језгара.
Иако су протони изворно сматрани основним или елементарним честицама, у савременом стандардном моделу физике честица протони су класификовани као хадрони, попут неутрона, који је исто тако нуклеон. Протони су композитне честице састављене од три валентна кварта: два горња кварка набоја +2/3 и једног доњег кварка набоја –1/3. Масе мировања кваркова доприносе само око 1% масе протона.[7] Остатак протонске масе настаје захваљујући енергији везивања квантне хромодинамике, која укључује кинетичку енергију кваркова и енергију глуонских поља која везују кваркове заједно. Како протони нису основне честице, они поседују мерљиву величину; средњи квадратни корен полупречника набоја протона је око 0,84–0,87 (или 0,84×10−15 до 0,87×10−15 m).[8][9] Године 2019, две различите студије, користећи различите технике, откриле су да је радијус протона 0,833 , са неизвесношћу од ±0,010 .[10][11]
Remove ads
Атомска теорија
У атомској теорији материје, атом се састоји од атомског језгра око кога круже електрони. Данас је генерално признато мишљење да се атомска језгра свих хемијских елемената састоји од позитивно набијених протона и неутрона који немају електрични набој. Честице које се налазе у атомском језгру, то јест протони и неутрони, зову се заједничким именом нуклеони (лат. : језгра). Неутрон има масу готово једнаку маси протона. Протон је језгро водониковог атома, те му је маса једнака маси атома водоника. Број протона у атомском језгру који се зове атомски број, једнак је њезином електричном набоју и увек одговара редном броју хемијског елемента у периодном систему. Дакле атомским бројем одређена је врста хемијског елемента.
У неутралном атому број електрона што круже око језгре једнак је броју протона у језгру. Позитиван набој једног протона једнако је велик као негативан набој електрона. Године 1869, руски хемичар Д. И. Мендељејев открио је законитост понављања хемијских својства елемената код повећања њихове атомске масе. Он је тада све познате елементе поређао по растућим атомским масама један изнад другога и саставио периодни систем. Мендељејев је доказао да сваки хемијски елемент има одређен састав атома који означава атомска маса и место у периодном систему елемената.
Број протона и неутрона у језгру одређује атомску масу одређеног елемента, то јест:
и зове се масени број атома. На пример језгро хелијума састоји се од два протона и два неутрона. Према томе је електрични набој језгра и редни број хелијума 2, а релативна атомска маса 4. Око атомског језгра круже негативно набијени електрони, а број електрона једнак је броју протона у језгру.
За дати број протона у језгри могу постојати различите количине неутрона. Два атома који имају исти број протона, а различити број неутрона, имају скоро иста хемијска својства и исти редни број, али различите атомске масе. Такви елементи који имају исти редни број, а различиту атомску масу, зову се изотопи. Тако на пример постоји хлор који има редни број 17, то јест његово језгро садржи 17 протона, док му је атомска маса 35, што значи да језгро његовог атома садржи 18 неутрона (17 + 18 = 35). Међутим, постоји и хлор с атомском масом 37, то јест језгро његовог атома садржи 20 неутрона (17 + 20 = 37). Обичан хлор који се налази у једињењима у природи има атомску масу 35,46, што значи да је он смеша та два изотопа који су у њему заступани у односу 3 : 1, то јест:
Први изотоп хлора пише се симболички 1735, а други 1737. Горњи број уз хемијски симбол елемента значи релативну атомску масу тог елемента, а доњи - број протона у језгру тог елемента, односно његов редни број. Водоник има три изотопа: 11 обичан водоник, 12 тешки водоник или деутеријум, и 13 трицијум.
Овакви изотопи нађени су готово код свих хемијских елемената. Тако уранијум, који је важан за добивање нуклеарне енергије, има 5 изотопа. Уранијум има редни број 92, а његови изотопи имају атомске масе 234, 235, 237, 238 и 239. У природном уранијуму најјаче је заступљен изотоп с атомском масом 238. Има га 137 пута више него изотопа с атомском масом 235. Осталих његових изотопа има још и мање. Изотопи се данас у знатној мери примењују у медицини, техници и привреди, а нарочито су веома важни у производњи нуклеарне енергије. Одељивање изотопа врши се центрифугирањем, дестилацијом, дифузијом и тако даље.
Да се језгро атома која се састоји од позитивно набијених протона не би распало, јер се истоимени електрични набоји међусобно одбијају, делују привлачне силе које владају, између протона и неутрона. То су такозване силе језгра или основне силе које, иако су врло велике, делују само на врло малим раздаљинама, то јест на димензијама атомског језгра. Тумачење тих сила се у данашње време убраја у главне проблеме атомске физике.[12]
Remove ads
Историја
Протон је 1918. открио Ернест Радерфорд. Он је запазио да при бомбардовању гасовитог азота алфа честицама, светлосни детектори показују присуство водониковог језгра. Радерфорд је закључио да је једино место одакле водоник може да потиче - азот, и стога азот мора садржати водониково језгро. Он је стога закључио да је водониково језгро, за које је било познато да има атомски број 1, елементарна честица. Овој честици је дао име протон од грчке речи — протос] — „први“.
Remove ads
Технолошке примене
Попут других елементарних честица, протон поседује спин. Ово својство је искоришћено у нуклеарној магнетној резонанцији (НМР спектроскопији).
Види још
Референце
Литература
Спољашње везе
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads