Цервикална интраепителна неоплазија
From Wikipedia, the free encyclopedia
Remove ads
Цервикална интраепителна неоплазија (CIN), цервикална дисплазија, цервикална интерстицијална неоплазија је преинвазивна промена на грлићу материце за коју се данас зна да, иако се не лечи, у већини случајева се спонтано повлачи. Међутим ова промене се током одређеног времена у овој промени се може развити у инвазивни карцином или рак грлића материце.[1][2]
Remove ads
Анатомија
Врат материце (лат. ) је њен доњи, цилиндрични део који се наставља на труп материце (лат. ). Спољна страна цервикса (лат. ), која штрчи у лумен вагине, као и сама материца обложена је вишеслојним плочастим епителом, док је унутрашња страна цервикса (лат. ) обложена једнослојним цилиндричним епителом.[3]
Место, у којем вишеслојни плочасти епител егзоцервикса прелази у једнослојни цилиндрични епител ендоцервикса, носи назива сквамоколумнарна граница (СКГ). У зависности од тренутног хормонског статуса и животне доби, положај сквамоколумнарне границе се мења.[1] У хормонски неактивним периодима (детињство и постменопауза) СКГ налази се дубље у цервикалном каналу, док је у хормонски активним периодима (новорођеначки период живота, пубертет, генеративни период живота, трудноћа и код жена које узимају оралне хормонске контрацептиве) СКГ померена ниже, ван цервикалног канала.[1] Када је сквамоколумнарна граница померена ниже, једнослојни цилиндрични епител који је осетљивији, на утицај ниског пХ у вагини замењује се отпорнијим, метапластичне плочастим епителом. Зато се на егзоцервиксу могу уочити две сквамоколумнарне границе и зона преображаја:
- Прва која је оригинална или примарна СКГ у којој једнослојни цилиндрични епител прелази у оригинални вишеслојни плочасти епител пре процеса метаплазије,
- Друга или секундарна СКГ која је активна, и у којој једнослојни цилиндрични епител прелази у метаплазијом промењени плочасти епител.
- Зона преображаја је подручје између примарне и секундарне сквамоколумнарна границе (или трансформатциона зона)).
Како је незрели метапластичне плочасти епител осетљив на деловање разних онкогених фактора цервикална интраепителна неоплазија (CIN) у највећем броју случајева почиње као жариште у зони преображаја.

Remove ads
Етиологија
Цервикална интраепителна неоплазија је примарна болест полно активних жена, а збога фактора ризика, сматра се и полно преносивом болешћу, за чији развој најзначајнију улогу има хумани папилома вирус (ХПВ).
Фактори ризика

Као могући фактори ризика повезани са развојем цервикалне интраепителне неоплазије наводе се:
- Рани почетак полне активности,
- Чешће мењање полних партнера,
- Инфекција хуманим папилома вирусом (ХПВ) високог ризика,
- Полно преносиве болести (нпр херпес, хламидије),
- Бројне трудноће и већи број порођаја,
- Употреба оралних контрацептива,
- Пушење цигарета.[4]
Иако се већина полно активних жена барем једном током живота зарази ХПВ-ом, та инфекција обично није трајна и у већине жена долази до спонтаног нестајања вируса без развоја болести.[5][6] Међутим у мање од 10% жена које се заразе ХПВ-ом, развиће се трајна инфекција која може прогредирати у теже облике цервикалне интраепителне неоплазије.[7][8] До сада је откривено више од 200 подтипова ХПВ који се у више од 95% случајева манифестује као преинвазивних и инвазивних карцинома цервикса[7][9] Хумани папилома вирус групише се у ХПВ високог и ниског ризика, у зависности од њиховог онкогена потенцијала.
- ХПВ високог онкогеног ризика
У ову групу ХПВ спадају: 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, и 68. Они могу узроковати интраепителне промене високог степена или карцином цервикса.[тражи се извор] ХПВ тип 16 и 18 су најчешће изоловани ХПВ типови, који узрокују више од 71% инвазивних карцинома. Међутим ХПВ тип 16 није специфичан јер се може наћи и у жена са CIN I и те код жена са уредним Папаниколу тестом.[7]
- ХПВ ниског онкогеног ризика
У ову групу ХПВ спадају: 6, 11, 41, 42, 43 и 44. Они су најчешће повезани са бенигним променама као што су кондиломи који ретко малигно алтерира.[7].[10][11]
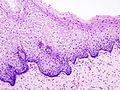
Макроскопске промене у цервикалној интраепителној неоплазији
Макроскопски, промене у цервикалној интраепителној неоплазији (CIN) су неспецифичне и могу се манифестовати као леукоплакија, ерозија цервикса, цервицитис или нема никаквих приметних промена. Хистолошки се унутар епитела налазе атипичне ћелије са хиперхромазијом језгара и митозе у површинским слојевима епитела, али без знакова инвазије у строму.[12]
Бројним истраживањима потврђено да је цервикална интраепителна неоплазије преканцероза и да у одређеном проценту жена он прелази у инвазивни карцином. Главна разлика између карцинома ин ситу и инвазивног карцинома је та што је код карцинома ин ситу танка базална мембрана, која дели епител од субепителног везивног ткива у којем се налазе крвни и лимфни судове, још увек интактна, док код инвазивног карцинома долази до продора малигних ћелија кроз базалну мембрану.[13][14]
Remove ads
Дијагноза
Основни критеријум за дијагнозу интраепителне неоплазије су:
- Неједнакост у облику и величини ћелија и једара,
- Поремећај сазревања,
- Поремећај односа цитоплазма - једро
- Присутност митоза.
С обзиром на дебљину захватања вишеслојног плочастог епитела неопластичким процесом, разликују се три степена цервикалне интраепителне неоплазије (CIN).[4]
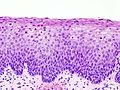
- CIN I
Промене код овог типа су најблажи облик цервикалне интраепителне неоплазије. Мерећи од базалне мембране, промене на ћелијама не захватају више од 1/3 дебљине епитела. У базалноме слоју налази се мали број митоза, а атипичне ћелије са атипичним једрима су ретке.
- CIN II
Овај облик неоплазије је средње тешки поремећај у коме су промене на ћелијама нешто израженије и присутне су у доње 2/3 епитела слузокоже мерећи од базалне мембране. Такође постоји поремећај у распореду и сазревању ћелија, уз видљиву присутност незрелих ћелија са повећаним садржајем хроматина. Слој базалних ћелија је проширен и садржава већи број митоза и већи број ћелија атипичног изгледа.
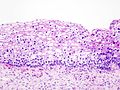
- CIN III
Ово је најтежи облик дисплазије и карцином ин ситу. У ово стадијуму диспластичне ћелије налазе се у више од 2/3 дебљине епитела или је захваћена цела дебљина епитела. Присутне су многобројне митозе и бројне ћелије са изразитим променама на једрима. Знаци сазревања и диференцијације епитела налазе се само у горњој трећини епитела.
Упоредни систем класификације премалигних промена грлића материце
Дијагноза се поставља на основу:
- Хистопатолошког прегледа узорка узетог биопсијом
- Ендоцервикалне киретаже
- Конизације
Remove ads
Терапија

У терапији цервикалне интраепителне неоплазија (ЦИН) углавном се користе хируршке методе, у облику локално деструктивних или ексцизијских метода, које се примењују у амбулантним или болничким условима. Примарни циљ лечења је да се у потпуности одстране и униште ћелије атипичног епитела.
Хируршка терапија
- Локалне деструктивне (аблативне) методе
Од локално деструктивних метода најчешће се користе: криотерапија, ласерска вапоризација, радикална дијатермија и хладна коагулација. Иако се локално деструктивне методе боље подносе и имају мање компликација, њихов главни недостатак у односу на ексцизијске методе је немогућност узимања узорка ткива за патохистолошку анализу.[1]
Локално деструктивне методе могу се користити ако је колпоскопија задовољавајућа, тј. ако се у потпуности прикаже зона трансформације, ако не постоји сумња на микроинвазивну или инвазивну болест, као и ако не постоји сумња на жљездану болест.
- Ексцизионе методе
Ексцизионе методе су обавезне уколико се колпоскопски не може у целости приказати зона трансформације или уколико постоји сумња на инвазивну и жлездану болест. Од ексцизијских метода данас се најчешће користе ласерска конизација и LLETZ (енгл. ).
Индикације за ексцизионе методе су:
- Ако лезија захвата ендоцервикалне канал
- Уколико постоје велике, комплексне лезије
- Код незадовољавајућег налаза (сквамоколумнарна граница није доступна прегледу)
- Ако не постоји корелација између цитологије и колпоскопије
- У случају рекурентне болести
Ласерска конизација се најчешће изводи у локалној анестезији уз помоћ ласерских зрака који истовремено режу и коагулишу тако да је након интервенције крварење минимално. Главни недостатак ове методе је могуће термичко оштећење ткива због чега би била немогућа анализа ивица промене.
Данас се све чешће у клиничкој пракси користи најпоштеднији (најмање инвазивни) дијагностичко-терапијски захват LLETZ који се изводи у локалној анестезији. Ова метода користи електродијатермијску петљу која истовремено реже и коагулише ткиво, и зато даје одличну хемостазу. За разлику од ласерске конизације, термичка оштећења су минимална и не утичу значајно на патохистолошку анализу ивица промене.[15]
- Постинтервенционо праћење болеснице
Независно од ризика за резидуалну или рекурентну интраепителну болест, све жене које су лечене због CIN-a имају пет пута већи ризик за настатанк инвазивног карцинома него општа популација и то независно од методе којом је рађена интервенција.[16] Због тога је обавезно праћење свих жена, најмање 10 године после третмана. У прве две године он се спроводи сваких шест месеци а након тога једном годишње. У случају атипије налаза обавезна је патохистолошка дијагностика
Remove ads
Види још
Референце
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads