பொட்டாசியம் மாங்கனேட்டு
From Wikipedia, the free encyclopedia
Remove ads
பொட்டாசியம் மாங்கனேட்டு (Potassium manganate) என்பது K2MnO4 என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட ஒரு கனிம வேதியியல் சேர்மமாகும். பொதுவான வேதிப்பொருளாக விளங்கும் பொட்டாசியம் பெர்மாங்கனேட்டைத் (KMnO4) தொழிற்சாலைகளில் தயாரிக்கும்போது இடைநிலை விளைபொருளாக பொட்டாசியம் மாங்கனேட்டு உருவாகிறது. பச்சை நிறத்தில் உள்ள இவ்வுப்பும் பொட்டாசியம் பெர்மாங்கனேட்டும் ஒன்று போல தோன்றினாலும் இரண்டும் வெவ்வேறு வகையான உப்புகளாகும். இவையிரண்டும் தனித்தனியாக வேறுபட்ட பண்புகளைக் கொண்டுள்ளன.
Remove ads
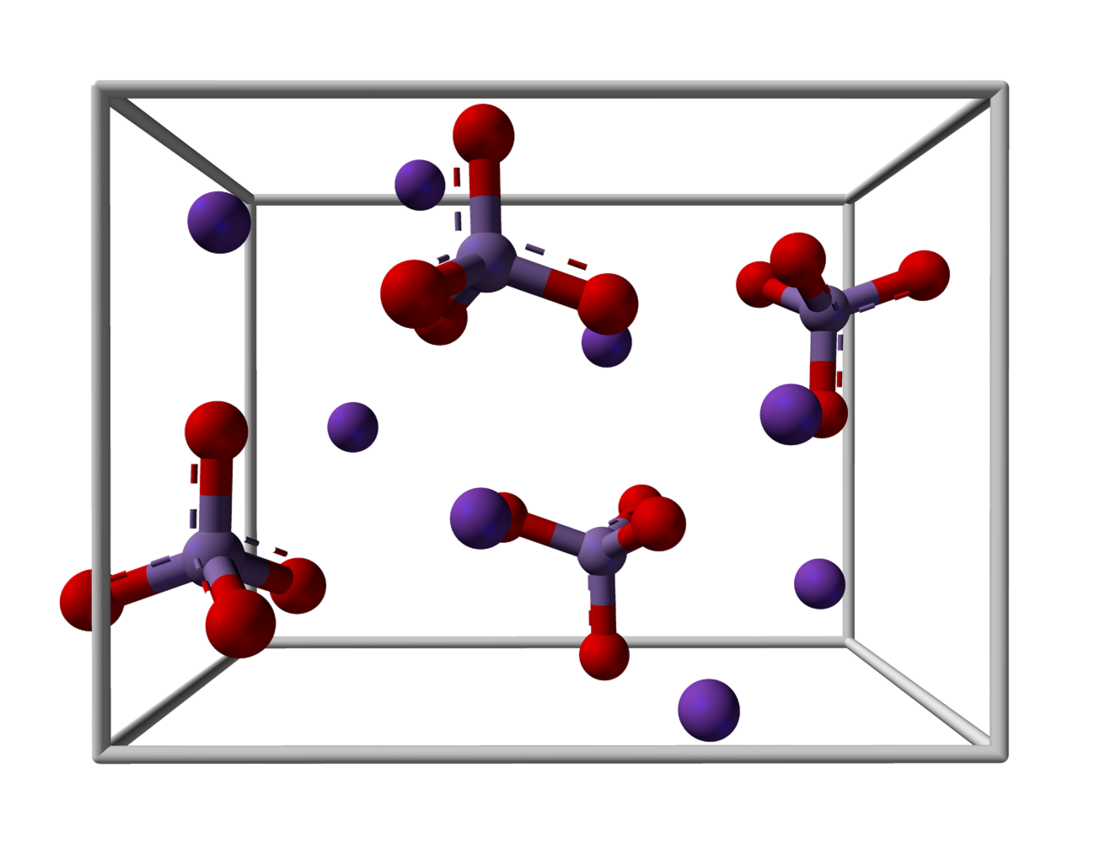
கட்டமைப்பு
K+ நேர்மின் அயனிகளும் MnO42− எதிர்மின் அயனிகளும் சேர்ந்து K2MnO4 என்ற உப்பு உருவாகிறது. Mn-O இடைவெளி 1.66 Å உடன் எதிர்மின் அயனி நான்முகி வடிவிலுள்ளதாக எக்சு கதிர் படிகவியல் முடிவுகள் தெரிவிக்கின்றன. KMnO4 இல் உள்ள Mn-O இடைவெளியுடன் ஒப்பிடுகையில் K2MnO4 இல் இது அதிகமான நீளமாகும்[1]. பொட்டாசியம் சல்பேட்டுடன் ஒப்பிடுகையில் பொட்டாசியம் மாங்கனேட்டு சமக்கட்டமைப்பைக் கொண்டிருக்கிறது.
தயாரிப்பு
MnO2 சேர்மத்தை காற்றில் எரிப்பதன் மூலம் பொட்டாசியம் மாங்கனேட்டைத் தொழில்முறையில் பேரளவில் தயாரிக்கிறார்கள்.
- 2 MnO2 + 4 KOH + O2 → 2 K2MnO4 + 2 H2O
இத்தகைய தன்மை மாற்றத்தால் பச்சை நிற உருகல் கிடைக்கிறது. அறியப்படாத மாதிரியுடன் பொட்டாசியம் ஐதராக்சைடைச் சேர்த்து காற்றில் எரிப்பதன் மூலம் பச்சைநிறம் தோன்றினால் அம்மாதிரியில் மாங்கனீசு இருக்கிறது என்பது ஒரு சோதனை முறையாகும். 610 நானோமீட்டரில் நிகழும் தீவிர ஈர்ப்பு இப்பச்சைநிறம் விளைவதற்கு காரணமாகும்.
KMnO4 உடன் அடர் பொட்டாசியம் ஐதராக்சைடு கரைசலைச் சேர்த்து சூடுபடுத்தி பின்னர் குளிரவைப்பதன் மூலம் பச்சைநிற படிகங்களாக பொட்டாசியம் மாங்கனேட்டை ஆய்வுக்கூடங்களில் தயாரிக்கிறார்கள் :[2]
- 4 KMnO4 + 4 KOH → 4 K2MnO4 + O2 + 2 H2O.
ஐதராக்சைடு ஓர் ஒடுக்கும் முகவராக செயல்படுவதற்கு இவ்வினை ஓர் அரிய உதாரணமாகும். 5-10 மோல் பொட்டாசியம் ஐதராக்சைடில் உள்ள KMnO4 கரைசலை அறைவெப்பநிலையில் கலக்கி ஒரு நாளைக்கு வைத்திருந்து கரையாத MnO2, வை நீக்கினால் கரைசலாக K2MnO4 உருவாகிறது. 610 நானோ மீட்டரில் இதன் உட்கிரகிப்பை அளவிடுதல் மூலமாக K2MnO4 கரைசலின் அடர்த்தியை சோதித்துக் கொள்ள முடியும்.
பெர்மாங்கனேட்டை மாங்கனேட்டாக ஒடுக்கும் ஓரெலக்ட்ரான் ஒடுக்கத்தை அயோடைடை ஒடுக்கும் முகவராகப் பயன்படுத்தி நிகழ்த்தலாம்.
- 2 KMnO4 + 2 KI → 2 K2MnO4 + I2
பெர்மாங்கனேட்டின் ஊதாநிறம் மாஙகனேட்டின் பச்சை நிறத்திற்கு மாறுவதைக் கொண்டு இம்மாற்றத்தை அடையாளம் காணலாம். வழக்கமாக ஆக்சிசன் மாற்ற முகவராகச் செயல்படும் மாங்கனேட்டு(VII) கூடுதலாக ஓர் எலக்ட்ரான் ஏற்பியாக பங்கேற்பதையும் இவ்வினையில் காணமுடியும்.
பேரியம் குளோரைடு முன்னிலையில் KMnO4 உடன் அயோடைடு சேர்த்து ஒடுக்குவதன் மூலம் பேரியம் மாங்கனேட்டைத் (BaMnO4) தயாரிக்கிரார்கள். உண்மையில் BaMnO4 அனைத்துக் கரைப்பான்களிலும் குறைவாகவே கரைகிறது.
தூய்மையான பொட்டாசியம் பெர்மாங்கனேட்டு படிகங்கள் அல்லது தூளை சூடுபடுத்தி, பொட்டாசியம் மாங்கனேட்டு தயாரிப்பதே ஆய்வகத்தில் பொட்டாசியம் மாங்கனேட்டு தயாரிப்பதற்கான ஒரு எளிமையான வழியாகும். இவ்வினையின்போது பொட்டாசியம் பெர்மாங்கனேட்டு, ஆகிசிசன், பொட்டாசியம் மாங்கனேட்டு, மாங்கனீசு டை ஆக்சைடாகச் சிதைவடைகிறது.
- 2KMnO4 → K2MnO4 + MnO2 + O2
இவ்வினை ஆய்வகத்தில் ஆக்சிசன் தயாரிக்கும் முறையாகும். ஆனால் பொட்டாசியம் மாங்கனேட்டு மாதிரிகள் MnO2 மாசுடன் கலந்து உருவாகிறது.
Remove ads
வினைகள்
மாங்கனேட்டு உப்புகள் விரைவில் மாங்கனீசு டை ஆக்சைடாகவும் பெர்மாங்கனேட்டு அயனியாகவும் விகிதச்சமமாதலின்மை அடைகின்றன.
- 3 K2MnO4 + 2 H2O → 2 KMnO4 + MnO2 + 4 KOH
அசாதாரணமான வண்ணமயமான பண்பினால் மாங்கனேட் / மாங்கனேட் (VII) இணை ஒரு வேதியியல் பச்சோந்தி என்று குறிப்பிடப்படுகிறது. இந்த விகிதசமமாதலின்மை வினை உயிர்மூலக்கூற்று இயக்கவியலை பின்பற்றி விரைவாக மாறுகிறது .
மேற்கோள்கள்
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads