வெள்ளீயம்(II) ஆக்சைடு
வேதிச் சேர்மம் From Wikipedia, the free encyclopedia
Remove ads
வெள்ளீயம்(II) ஆக்சைடு (Tin(II) oxide) என்பது SnO என்ற மூலக்கூற்று வாய்ப்பாட்டால் விவரிக்கப்படும் ஒரு கனிம வேதியியல் சேர்மமாகும். சிடானசு ஆக்சைடு என்ற பெயராலும் இச்சேர்மம் அழைக்கப்படுகிறது. வெள்ளீயம் மற்றும் ஆக்சிசன் தனிமங்கள் சேர்ந்து வெள்ளீயம்(II) ஆக்சைடு உருவாகிறது. இச்சேர்மத்தில் +2 என்ற ஆக்சிசனேற்ற நிலையில் வெள்ளீயம் காணப்படுகிறது. நிலைப்புத் தன்மை மிக்க கரு-நீலம் நிற வெள்ளீயம்(II) ஆக்சைடு, சிற்றுறுதி நிலை சிவப்பு வெள்ளீயம்(II) ஆக்சைடு என்ற இரண்டு வகைகளில் இச்சேர்மம் காணப்படுகிறது.
Remove ads
தயாரிப்பு
வெள்ளீயம்(II) உப்பு சோடியம் ஐதராக்சைடு போன்ற காரத்துடன் வினைபுரியும்போது உருவாகும் வெள்ளீயம்(II) ஆக்சைடு நீரேற்றை (SnO•xH2O (x<1)) சூடுபடுத்தினால் நீலம் கலந்த கருப்பு நிறத்தில் வெள்ளீயம்(II) ஆக்சைடு வீழ்படிவாக உருவாகிறது [4]
.
ஒரு வெள்ளீயம்(II) உப்பு மீது நீரிய அமோனியாவின் செயலால் உற்பத்தி செய்யப்படும் வீழ்படிவை மென்மையாக வெப்பப்படுத்துவதன் மூலம் சிற்றுறுதி நிலை சிவப்பு வெள்ளீயம்(II) ஆக்சைடை தயாரிக்க முடியும் [4]
.
சிடானசு ஆக்சலேட்டு எனப்படும் வெள்ளீயம்(II) ஆக்சலேட்டை காற்று இல்லாமல் கட்டுப்படுத்தப்பட்ட கார்பன் டை ஆக்சைடு சூழலில் சூடுபடுத்தினால் தூய்மையான வெள்ளீயம்(II) ஆக்சைடை ஆய்வகங்களில் தயாரித்துக் கொள்ள முடியும். இதேமுறையில் பெர்ரசு ஆக்சைடும் மாங்கனசு ஆக்சைடும் தயாரிக்கப்படுகின்றன [5][6]
- SnC2O4•2H2O → SnO + CO2 + CO + 2 H2O
Remove ads
வினைகள்
வெள்ளீயம்(II) ஆக்சைடு காற்றில் மங்கலான பச்சை நிற சுவாலையுடன் எரிந்து வெள்ளீயம் டையாக்சைடு (SnO2) உருவாகிறது.[4]
- 2 SnO + O2 → 2 SnO2.
மந்த வாயுச் சூழலில் வெள்ளீயம்(II) ஆக்சைடு சூடுபடுத்தப்பட்டால் விகிதச்சமநிலையின்மை தோன்றி முதலில் வெள்ளீயம் உலோகமும் Sn3O4 சேர்மமும் உருவாகின்றன. இது மேலும் வினைபுரிந்து சிடானிக் ஆக்சைடும் வெள்ளீயம் உலோகமும் உருவாகின்றன [4]
- 4SnO → Sn3O4 + Sn
- Sn3O4 → 2SnO2 + Sn.
வெள்ளீயம்(II) ஆக்சைடு சேர்மம் ஈரியல்பு நிலை கொண்ட சேர்மமாகும். வலிமையான அமிலங்களில் இது கரைந்து வெள்ளீயம்(II) உப்புகளைக் கொடுக்கிறது. இதேபோல வலிமையான காரங்களுடன் வினைபுரிந்து Sn(OH)3− அயனிகளைக் கொண்ட சிடானைட்டுகளைக் கொடுக்கிறது [4]. வலிமையான அமிலக் கரைசல்களில் கரையும்போது Sn(OH2)32+ மற்றும் Sn(OH)(OH2)2+ அயனிகளைக் கொண்ட அணைவுச் சேர்மங்கள் உருவாகின்றன, இதேபோல வலிமை குறைந்த அமிலக் கரைசல்களில் கரைந்து Sn3(OH)42+ அயனிகளைக் கொண்ட அணைவுச் சேர்மங்கள் உருவாகின்றன [4].
K2Sn2O3, K2SnO2 போன்ற நீரற்ற சிடானைட்டுகளும் அறியப்படுகின்றன [7][8][9]. SnO ஓர் ஒடுக்கும் முகவரும் ஆகும். தாமிரம்(I) சேர்மங்களை தாமிர ரூபி கண்ணாடி தயாரிப்பில் இது உலோகக் தொகுதிகளாக குறைக்கிறது [10].
Remove ads
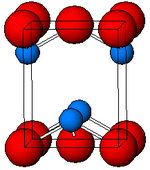
கட்டமைப்பு
கருப்பு நிற α-SnO நாற்கோண PbO அடுக்கு கட்டமைப்பை ஏற்கிறது. இதில் நான்கு ஒருங்கிணைவுகள் கொண்ட சதுர கூர்நுனிக் கோபுர வெள்ளீய அணுக்கள் உள்ளன[11]. அரியவகை ரோமார்கைட்டு என்ற கனிமத்தில் இவ்வடிவம் இயற்கையில் காணப்படுகிறது[12].
சமச்சீரற்ற தன்மை பொதுவாக சுறுசுறுப்பான செயலில் உள்ள தனி இணை எலக்ட்ரானுக்கு வெறுமனே கூறப்படுகிறது; இருப்பினும், எலக்ட்ரான் அடர்த்தி கணக்கீடுகள் Sn (5s) மற்றும் O (2p) சுற்றுப்பாதைகளின் பிணைப்பெதிர் தொடர்பு காரணமாகவே இச்சமச்சீரற்ற தன்மை ஏற்படுகிறது என்பதைக் காட்டுகிறது [13]. விகிதச்சமமின்மையும் SnO சேர்மத்தில் அறியப்படுகிறது [14]. 2.5eV மற்றும் 3eV என்ற அளவுகளுக்கு இடைப்பட்ட மின்னாற்றல் இடைவெளியும் இதில் அறியப்படுகிறது [15].
பயன்கள்
மற்ற மூவிணைதிற வெள்ளீயம் சேர்மங்களை அல்லது உப்புகளை தயாரிப்பதற்கான முன்னோடிச் சேர்மமாக சிடானசு ஆக்சைடு பெரிதும் பயன்படுகிறது. இதுவொரு ஒடுக்கும் முகவராகவும் ரூபி கண்ணாடிகள் உருவாக்கத்தில் பயன்படுகிறது. [16]. எசுத்தராக்கல் வினையிலும் இது ஒரு வினையூக்கியாக சிறிய பயன்பாட்டைக் கொண்டுள்ளது. பீங்கான் வடிவத்தில் உள்ள சீரியம்(III) ஆக்சைடுடன் வெள்ளீயம்(II) ஆக்சைடு (SnO) சேர்த்து புற ஊதா ஒளியுடன் ஒளிர்தலுக்கு பயன்படுத்தப்படுகிறது[17].
Remove ads
மேற்கோள்கள்
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads