Топ питань
Часова шкала
Чат
Перспективи
Важка вода
хімічна сполука З Вікіпедії, вільної енциклопедії
Remove ads
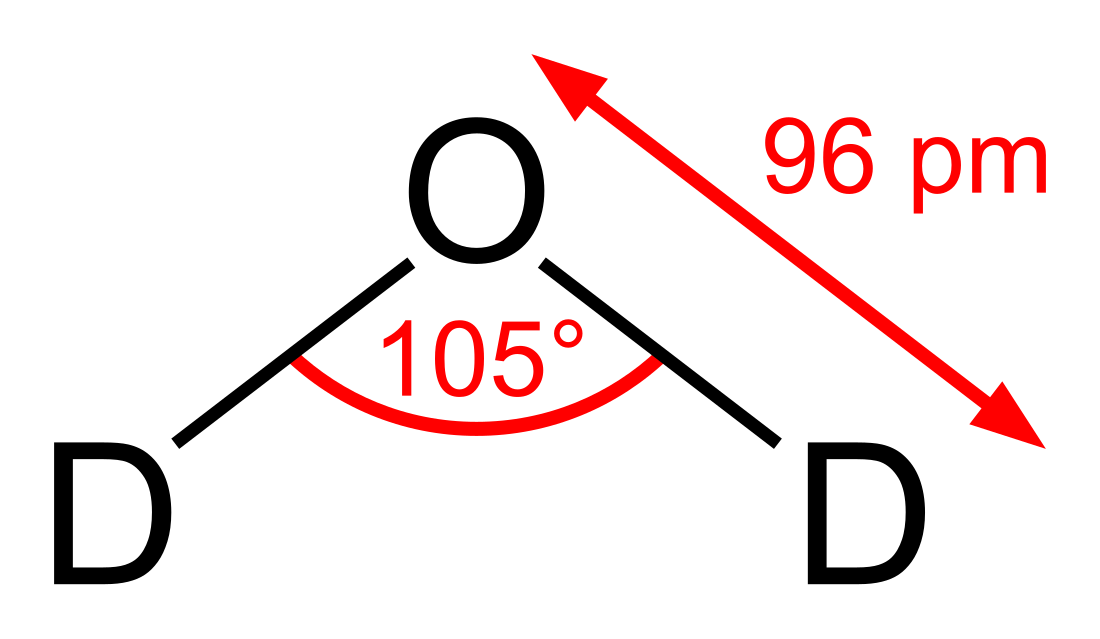
Важка́ вода́ (D2O) — вода, молекула якої складається з двох атомів дейтерію та атома кисню. Вода з формулою HDO називається напівважкою, а H2O — легкою.
Remove ads
Порівняння фізичних властивостей важкої та легкої води
Молекула важкої води доволі суттєво відрізняється за масою від молекули легкої води, внаслідок чого помітно відрізняються також фізичні властивості.
Remove ads
Поширення у природі
Природна вода містить невелику кількість атомів дейтерію у складі молекул напівважкої води HDO. Одна така молекула припадає на 3200–3800 молекул легкої води. Важкої води з формулою D2O дуже мало, оскільки ймовірність двох атомів дейтерію зустрітися у складі однієї молекули води в природі мала (близько 0,5×10-7).
Важка вода зустрічається в природі практично у всіх природних водоймах, однак вміст її складає мільйонні частки відсотка. При цьому в ізольованих водоймах в областях, де відзначаються спекотні кліматичні умови, а також в океанічних водах екватора і тропіків вміст важкої води більше. А в Антарктиді та льодах Гренландії її присутність є мінімальною[2]. Наразі існує гіпотеза про те, що важка вода може міститися в донному льоді.[3][4][5] Гіпотеза викликала інтерес фахівців.[6] На думку мерзлознавця Алексєєва В. Р., якщо ця гіпотеза підтвердиться, «заготівля» важкої води стане справою техніки[2].
Remove ads
Отримання
Узагальнити
Перспектива
Оскільки різниця у властивостях дейтерію та протію є невеликою, коефіцієнти розділення для різних методів також є невеликими і тому виробництво важкої води пов'язане із необхідністю проведення багатоступеневого протиструменевого процесу концентрування, що здійснюється у каскаді багатоступеневих апаратів.
Ряд методів отримання важкої води не мають промислового значення внаслідок низької продуктивності (дифузія, термодифузія, адсорбція), невеликого коефіцієнту розділення (абсорбція, екстракція), важкості здійснення протитоку (дробна кристалізація, зонне плавлення). Концентрація атомів дейтерію збільшується при електролізі, оскільки на електродах виділяється відносно вища доля протію. Основним методом отримання важкої води є багаторазовий електроліз у комбінації із ізотопним обміном між водою та воднем, ректифікація води, низкотемпературна ректифікація водню, двохтемпературний обмін між водою та сірководнем.
Сполученням у каскад окремих пар багатоступеневих апаратів, які працюють один за низької, інший за високої температур, вперше запропонували Гартек й Зюсс. Розміри ступенів у каскаді зменшуються зворотно пропорційно підвищенню концентрація, проведення двохтемпературного процесу по такій схемі пов'язане із багатократним повторенням нагрівання та охолодження потоків, що обумовлює великі витрати енергії[7].
Використання
Важка вода використовується як сповільнювач нейтронів у ядерних реакторах. Таке використання зумовлене тим, що на відміну від легкої води, важка вода набагато менше поглинає нейтрони.
Біологічна роль та фізіологічна дія
Узагальнити
Перспектива
Важка вода слабко токсична, хімічні реакції в її середовищі проходять дещо повільніше у порівнянні зі звичайною водою, водневі зв'язки з участю дейтерію дещо міцніші від звичайних. Експерименти над ссавцями (миші, щури, собаки)[8] показали, що заміщення 25 % протію в тканинах дейтерієм призводить до стерильності, іноді незворотної[9][10]. Вищі концентрації призводять до швидкої загибелі тварини; так, ссавці, що пили важку воду протягом тижня, загинули, коли половина води в їхньому тілі була дейтерована; риби та безхребетні гинуть лише при 90 % дейтеруванні води в тілі[11]. Найпростіші здатні адаптуватися до 70 % розчину важкої води, а водорості й бактерії здатні жити навіть у чистій важкій воді[8][12][13][14][15].
Людина може без видимої шкоди для здоров'я випити кілька склянок важкої води, увесь дейтерій буде виведений з організму через кілька днів. Таким чином, важка вода набагато менш токсична, ніж, наприклад, кухонна сіль.
Важка вода використовувалася для лікування артеріальної гіпертензії у людей в добових дозах від 10 до 675 г D2O за день[16].
В організмі людини міститься у вигляді природної домішки стільки ж дейтерію, скільки у 5 грамах важкої води; цей дейтерій переважно входить до складу молекул напівважкої води HDO, а також усіх інших біологічних сполук, що містять водень.
Remove ads
Інші різновиди важких вод
У природі існує два стабільних ізотопи водень — протій (позначається 1H чи H) і дейтерій (2H чи D), та три — кисню (16O, 17O і 18O). Це дає дев'ять нерадіоактивних різновидів молекул сполуки з формулою H2O. Сполука H216O називається легкою водою, H218O — важкокисневою, HD16O — напівважкою і D216O — важкою водою.
З урахуванням радіоактивного тритію (3H чи T) загальна кількість різновидів важкої води зростає до 18. T216O називають надважкою водою.
Формально, якщо врахувати усі відомі ізотопи водню (7) та кисню (17), можна отримати 476 різновидів важкої води. Однак період піврозпаду радіоактивних ізотопів водню, важчих від тритію, та інших — окрім зазначених вище — ізотопів кисню дуже малий, тому отримати макроскопічні зразки води з такими ізотопними різновидами неможливо.
Remove ads
Цікаві факти
На смак важка вода дещо солодка, "немов у воду додали трохи цукру". Принаймні так стверджує Канадійський ютубер-хімік NileRed(справжнє ім'я Найджел Браун), який опублікував відео споживання важкої води і описав її смак. Також, дослідним шляхом було встановлено, що важка вода не лише має солодкий смак, але і збільшує інтенсивність солодкого смаку інших речовин (вуглеводів, синтетичних підсолоджувачів), не змінюючи інтенсивність інших модальностей смаку[17].
Remove ads
Див. також
Примітки
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads