Топ питань
Часова шкала
Чат
Перспективи
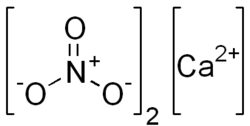
Нітрат кальцію
хімічна сполука З Вікіпедії, вільної енциклопедії
Remove ads
Нітра́т ка́льцію, ка́льцій нітра́т (кальцієва селітра, азотнокислий кальцій, вапнякова селітра, норвезька селітра) — неорганічна сіль нітратної кислоти складу Са(NO3)2. Являє собою білі кристали, сильно гігроскопічні, які легко утворюють кристалогідрати. Для уникнення цього речовину зберігають без доступу вологи. Широко використовується як добриво, а також у виготовленні бетону і вибухівки.
Remove ads
Фізичні властивості
Нітрат кальцію є високогігроскопічною сполукою, яка може утворювати кристалогідрати, зв'язуючи до чотирьох молекул води. Якщо водний розчин нітрату кальцію упарювати до температури 40 °C, то випадатимуть кристали Ca(NO3)2·4H2O, при підвищенні температури до 45 °C виділятиметься Ca(NO3)2·3H2O, при 51 °C — Ca(NO3)2·2H2O, а вище 55 °C — безводні кристали Ca(NO3)2.
Отримання
Узагальнити
Перспектива
У промислових масштабах нітрат кальцію отримують дією нітратної кислоти на вапняки:
Історично цей метод вперше застосували норвезькі промисловці, тому сполука отримала назву «норвезька селітра». Іншим методом отримання нітрату є обробка оксидом азоту(IV) деяких сполук кальцію:
Виробляють сполуку у гранульованій формі та у вигляді лусочок. З огляду на гігроскопічність нітрату, іноді, для її зменшення, Ca(NO3)2 змішують з гідрофобними добавками — 4–7% нітрату амонію NH4NO3, а також 0,5–1,0% парафінистого мазуту.
Remove ads
Хімічні властивості
Узагальнити
Перспектива
При нагріванні не вище 500 °C нітрат кальцію розкладається на нітрит кальцію та кисень, а за температури понад 561 °C утворюється оксид кальцію:
При відновленні активним воднем, отриманим в результаті взаємодії металу з кислотою, нітрат кальцію відновлюється до нітриту:
Remove ads
Застосування
Ca(NO3)2 широко застосовується у сільському господарстві як азотвмісне добриво. Також сполука знайшла застосування у виготовленні бетону та вибухівки.
Див. також
Джерела
- CRC Handbook of Chemistry and Physics / D. R. Lide. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- Реми Г. Курс неорганической химии / А. В. Новоселова. — М. : ИИЛ, 1963. — Т. 1. — 922 с. (рос.)
- Рипан Р., Четяну И. Неорганическая химия: Химия металлов / В. И. Спицын. — М. : «Мир», 1971. — Т. 1. — 561 с. (рос.)
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ / Р. А. Лидин. — 3-е. — М. : Химия, 2000. — 480 с. — ISBN 5-7245-1163-0. (рос.)
- Химический энциклопедический словарь / И. Л. Кнунянц. — М. : Сов. энциклопедия, 1983. — 792 с. (рос.)
Remove ads
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads