Топ питань
Часова шкала
Чат
Перспективи
Електрохімічний елемент
пристрій, де використовуються окисно-відновні реакції для продукування електричного струму, або ж електричний струм використовується для З Вікіпедії, вільної енциклопедії
Remove ads
Електрохімічний елемент (англ. electrochemical cell) — пристрій, де використовують окисно-відновні реакції для продукування електричного струму, або ж електричний струм використовують для проведення окисно-відновних реакцій в бажаному напрямкові.[1] В такому елементі два електроди розміщено в електроліті.[2] Можуть використовувати як різнорідні електроліти, так і однорідні.[2] Є два типи електрохімічних елементів: гальванічний і електролітичний.[3] Умовою для створення електрохімічного елемента, призначеного для використання в ролі джерела електроживлення, є те, що на два електроди, які занурені в електроліт, він (електроліт) має створювати різну хімічну дію, унаслідок чого буде утворюватись струм, який можна виміряти амперметром.
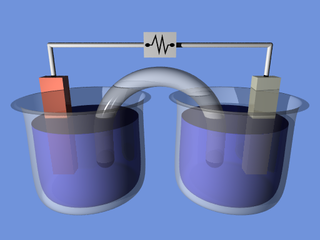
У конструкції електрохімічного елемента може бути передбачено використання:
- двох однакових (ідентичних) електродів[2][4];
- двох різнорідних[4] електродів, наприклад:
- катоди літієвих джерел струму, виготовлені на основі флуориду магнію шляхом нанесення MgF2 в складі пастоподібної суміші на нікелеву сітку, а літієвий анод виготовляють шляхом напресування металічного літію на таку ж нікелеву сітку[5];
- електрохімічний елемент може бути виконаний на базі модифікованого полярографічного електроду типу Clark із платиновим катодом і срібним анодом[6], та ін.;
- трьох електродів, наприклад:
- катод, літієвий анод і аналогічний з анодом протиелектрод, або порівняльний електрод[7][8];
- електрохімічний елемент, у якому як робочий електрод використовують активований вуглецевий матеріал з відповідним процентним вмістом марганцю, допоміжним електродом є платиновий електрод, а електродом для порівняння — хлор-срібний електрод Ag/AgCl[9];
- як робочий електрод (індикаторний) використовують вуглеситаловий електрод, допоміжний електрод — золотий, електрод для порівняння — хлор-срібний, типу ЕВМ-1М[10];
- Триелектродна схема може бути виконана як із нерозділеним, так і розділеним анодним та катодним простором[10][11];
Реактивні характеристики електрохімічного елемента визначають також на змінному струмі.[2]
Найпростішим електрохімічним елементом є елемент Вольта, в якому використовують цинковий і мідний електроди, занурені в розчин сірчаної кислоти. Кожен з електродів, зокрема разом з електролітом, в який він занурений, утворює напівелемент.
Remove ads
Найменування електрохімічних елементів
Електрохімічні елементи часто іменують на честь їх винахідників: Елемент Гальвані (так звані «гальванічні елементи»), Елемент Бунзена, Елемент Кларка, Елемент Лекланше, Елемент Данієля, Елемент Вестона. Звичайно, ці елементи різняться індивідуальними конструкційними особливостями та електрохімічними характеристиками.
Застосування
- У електричних батареях
- При виготовленні пористих напівпровідників методом електрохімічного травлення: в електрохімічних елементах з трьома або чотирма електродами створюються пористі шари на поверхні пористих напівпровідників. Таке електрохімічне травлення — відносно простий і дешевий метод.
- У вольтамперометричних дослідженнях селену та важких металів на водних об'єктах і под.
- Генерація водню для систем енергозабезпечення.
Remove ads
Див. також
Примітки
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads
