Топ питань
Часова шкала
Чат
Перспективи
Кукурбітурил
З Вікіпедії, вільної енциклопедії
Remove ads
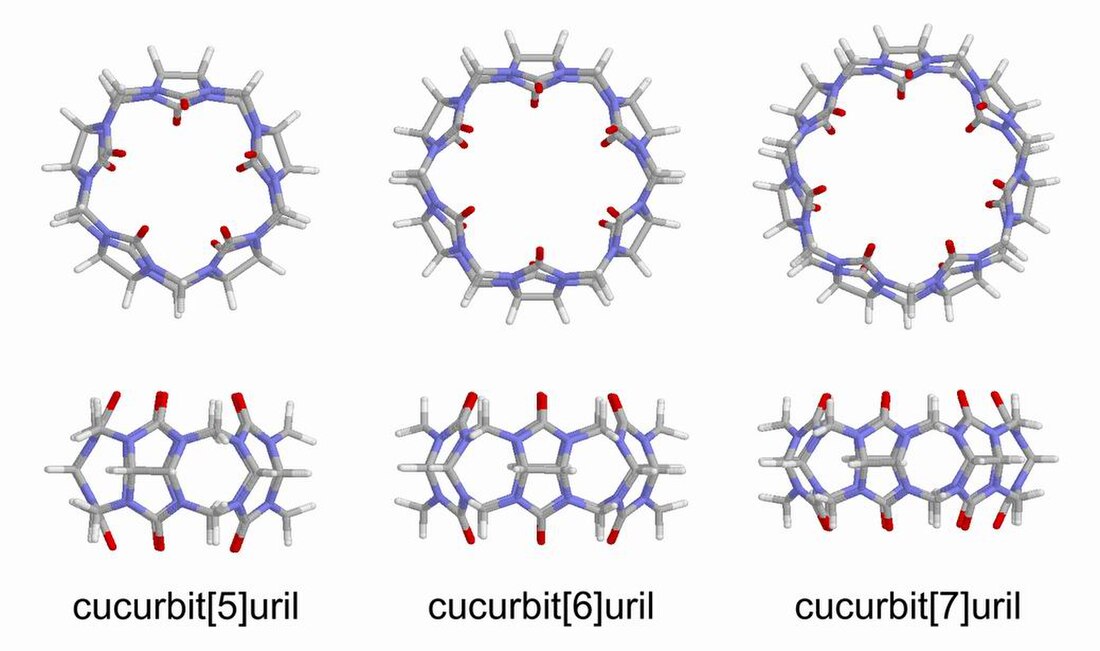
Кукурбітурили — макроциклічні молекули, утворені з гліколурилових[en] мономерів, з’єднаних метиленовими містками . Атоми кисню розташовані по краях циклу і нахилені всередину, утворюючи частково закриту порожнину. Назва походить від схожості молекул цієї групи з гарбузом, родина лат. Cucurbitaceae.

Назви кукурбітурилів зазвичай подаються у наступному вигляді — кукурбіт[n]урил, де n — кількість повторень гліколурилових залишків. Дві поширені абревіатури — CB[n], або просто CBn.
Ці сполуки становлять особливий інтерес для хіміків, оскільки вони є підхожими "господарями" для ряду нейтральних молекул та катіонів. Вважається, що взаємодія відбувається через гідрофобні взаємодії у випадку з нейтральними молекулами, а у випадку з катіонами і через катіон-дипольні взаємодії також. Порядок розміру кукурбітирилів є, як правило, 10 Å. Наприклад, порожнина кукурбіт[6]урила має висоту ~ 9,1 Å, зовнішній діаметр ~ 5,8 Å і внутрішній діаметр ~ 3,9 Å.[1]
Вперше кукурбітурили були синтезовані в 1905 році Робертом Берендом[en] шляхом конденсації гліколурилу з формальдегідом,[2] але їх структура не була встановлена до 1981 року.[3]

У 2008 році CB[5], CB[7] та CB[8] виявив та ізолював Кім Кімун (Kim Kimoon).[6] На сьогоднішній день було ізольовано кукурбітурили, що складаються з 5, 6, 7, 8 і 10 гліколурилових залишків,[7][8] об’єм їх внутрішніх порожнин становить 82, 164, 279, 479 та 870 Å3, відповідно. CB[14] був виділений також, однак його внутрішня порожнина менша від CB[7] та CB[8] (CB[14] не може вмістити всередині молекули, що поміщаються в CB[7] та CB[8]). Причиною цьому є те, що CB[14] має не фому "ідеального" кола, як інші кукурбітурили, а утворює петлю.[4] Кукурбіт[9]урил ще не виділений (станом на 2020 рік). Інші поширені молекулярні капсули, які мають подібну молекулярну форму з кукурбітурилами, містять циклодекстрини, каліксарени та пілларарени[en].
Remove ads
Синтез
Узагальнити
Перспектива

Кукурбітурили є амідалами і синтезуються з сечовини 1 та діальдегіду (наприклад, гліоксалю 2 ) шляхом нуклеофільного приєднання, як результат утворюється проміжний продукт, гліколурил 3. Цей проміжний продукт 3 конденсується з формальдегідом 4, як результат утворюється гексамеровий кукурбіт[6]урил, за умови, що температура реації вище 110°С. Зазвичай багатофункціональні мономери, такі як 3, зазнають ступеневої полімеризації, яка дає розподіл продуктів (полімерів різної маси), але завдяки сприятливому геометричному напруженню в молекулі та великій кількості водневих зв'язків гексамер 5 є єдиним продуктом реакції, виділеним після осадження.[7]
Використання нижчої температури синтезу (75-90 °C) дає можливість отримати кукурбітурили інших розмірів, включаючи CB[5], CB[7] ,CB[8] та CB[10]. CB[6] все рівно буде отриманий як основний продукт заа цих умов; але інші кукурбітурили будуть сформовані також, хоча і у меншій кількості. Ізоляція кукурбітурилів відмінних від CB[6], вимагає дробової кристалізації та розчинення. CB[5], CB[6], CB[7] та CB[8] зараз є комерційно доступними. Отримання кукурбітурилів більших розмірів є активною областю досліджень, оскільки вони можуть захоплювати більші та цікавіші гостьові молекули, розширюючи тим самим їх потенційне застосування.

Кукурбіт[10]урил особливо важко виділити. Вперше він був виявлений у 2002 році шляхом дробової кристалізації реакційної суміші. Він сформував комплекс включення, тобто CB[10] містив у своїй порожнині CB[5].[9] Комплекс CB[10]•CB[5] був однозначно ідентифікований за допомогою рентгенівського структурного аналізу на кристалі, який виявив, що комплекс нагадує молекулярний гіроскоп. Вільне обертання CB[5] всередині порожнини CB[10] імітує незалежне обертання маховика у гіроскопі.
Виділення чистого CB[10] неможливо здійснити методами прямого розділення, оскільки сполука має високу спорідненість до CB[5]. Сильну спорідненість до CB[5] можна пояснити розміром CB[5], який відповідає розміру та формі порожнини CB[10]. Чистий CB[10] був виділений у 2005 р., з використанням меламін діаміну, що міг більш міцно зв’язатись з CB[10], і таким чином витіснити CB[5].[8] Потім меламіндіамін був відокремлений від СВ[10] реакцією з оцтовим ангідридом, який перетворив позитивно заряджені аміногрупи меламіндіаміну в нейтрально заряджені аміди. Кукурбітурили мають міцний зв'язок з позитивно зарядженими молекулами, але втрата позитивного заряду меламін діаміну зменшила константу асоціації двох молекул до такої міри, що меламіндіамін можна було видалити промиванням метанолом, ДМСО та водою. CB[10] має надзвичайно велику порожнину (870 Å3), яка є вільною і здатною приймати надзвичайно великі молекули, "гості", включаючи позитивно заряджений калікс[4]арен.
Remove ads
Використання
Узагальнити
Перспектива
Кукурбітурили цікавлять хіміків у різних контекстах, включаючи доставку ліків, асиметричний синтез, молекулярні перемикачі та модифікацію барвників.

Супрамолекулярні комплекси господар-гість
Кукурбітурили є ефективними молекулами господарями в молекулярному розпізнаванні і мають особливо високу спорідненість до позитивно заряджених (катіонних) сполук. Високі константи асоціації з позитивно зарядженими молекулами забезпечуються карбонільними групами, які взаємодіють з катіонами подібно до краун-етерів. Спорідненість кукурбітирилів може бути дуже високою. Наприклад, константа рівноваги спорідненості курбурбіт[7]урилу з позитивно зарядженим гідрохлоридом 1-аміноадамантану була експериментально визначена, вона становить 4.23*1012.[11]
Взаємодії типу господар-гість суттєво впливають на розчинність кукурбітурилів. Кукурбіт[6]урил погано розчиняється майже в будь-якому розчиннику, але його розчинність значно покращується в присутності гідроксиду калію або в кислому розчині. Так, кукурбіт[6]урил формує позитивно заряджений комплекс включення (кавітанд) з іоном калію або іоном гідронію відповідно. Сформований комплекс має розчинність набагато більшу ніж некомплексована нейтральна молекула кукурбіт[6]урилу.[12]
CB[10] є достатньо великим для вміщення інших молекулярних господарів, таких як молекула каліксарену. Каліксарен може мати різні хімічні конформації, які перебувають у швидкій рівновазі. Алостеричний контроль забезпечується включенням молекули адамантану до каліксарену, яка змушує каліксарен набути конформації конуса.[8]
Ротаксанові макроцикли
Враховуючи високу спорідненість до утворення комплексів включення, кукурбітурили використовувались як макроциклічний компонент ротаксану. Наприклад, кукурбіт[6]урил може виступати як макроциклічний компонент, а гексаметилендіамін як центральна ланка. Після утворення супрамолекулярного комплексу між ними, аміногрупи на кінцях молекули центральної ланки реагують з ацилхлоридом утворюючи об'ємні закінчення, що діють як пробки та перешкоджають роз'єднанню двох молекул.[13]
В іншій ротаксановій системі з макроциклом CB[7] віссю (центральна ланкою) виступає 4,4'-біпіридин з двома аліфатичними N-замісниками, що закінчуються карбоновою кислотою.[14] У воді з концентрацією вище 0,5 мМ комплексоутворення є кількісним без необхідності "пробок". При рН = 2 карбоксильні групи протонізуються, а CB[7] рухається від одного кінця молекули центральної ланки до іншого, що підтверджується спектром ЯМР протона. При рН = 9 макроцикл замикається навколо 4,4'-біпіридинового центру молекули. Зовсім недавно був синтезований ротаксан з макроциклом CB[8]. Цей ротаксан може зв’язувати нейтральні гостьові молекули.[15]
Носій для доставки ліків
Властивості кукурбітурила формувати комплекси господар-гість може бути використана для адресної доставки ліків в організмі. Потенціал у цій сфері був досліджений на кукурбіт[7]урилу, який утворює сполуку включення з оксаліплатином, важливим препаратом, що бореться з раком. CB[7] застосовували, незважаючи на те, що його важче ізолювати, оскільки він має ліпшу розчинність у воді ніж інші кукурбітурили, а його більший розмір порожнини дозволяє вмістити молекулу оксаліплатину. Встановлено, що отриманий комплекс має підвищену стабільність та більшу селективність, що може призвести до меншої кількості побічних ефектів.[16]
Супрамолекулярні каталізатори
Кукурбітурили також досліджувались як супрамолекулярні каталізатори. Більші кукурбітурили, такі як кукурбіт[8]урил, можуть зв’язувати декілька гостьових молекул одночасно. CB[8] утворює 2:1 комплекс (гість:господар) з (E)-діаміностилбеном дигідрохлоридом, дві молекули якого можуть розміститися в CB[8] завдяки значному внутрішньому діаметру і висоті макроцикла (8,8 Å і 9,1 Å відповідно).[17] Просторова близькість та оптимальна орієнтація гостьових молекул у порожнині підвищує швидкість фотохімічної циклізації з отриманням димеру циклобутану зі стереоселективністю 95:5 для конфігурації syn. За відсутності CB[8] реакція циклізації не відбувається, а спостерігається лише ізомеризація вихідного продукту з транс-ізомеру до цис-ізомеру.[18][19]
Модифікація барвників
Можливість модифікації властивостей барвників кукурбітурилами була досліджена останніми роками. Було встановлено, що низькополярне середовище, що забезпечуються кукурбітурилами, може призводити до підвищеної яскравості та фотостабільності, збільшення часу флуоресценції та сольватохромізму.[20][21][22][23]
Remove ads
Споріднені сполуки
Інвертовані кукурбітурили або iCB[n] є аналогами CB з однією інвертованою молекулою гліколурилу. У інвертованому гліколурилі два протони метину (>CH-) спрямовані в порожнину, що робить її менш просторою. Інвертовані кукурбітирили утворюються як побічний продукт у реакціях синтезу CB, з виходом між 0,4 та 2%. Їх можливо ізолювати, оскільки вони мають нижчу спорідненість при утворенні комплексів включення порівняно із звичайними СВ. Вважається, що інвертовані кукурбітурили є кінетично контрольованими (проміжними) продуктами реакції, оскільки їх нагрівання у кислому середовищі призводить до формування суміші звичайних кукурбітурилів.[24]
Кукурбітурил, "розрізаний" навпіл уздовж екватора, називається гемікукурбітуриломом.
Систематична назва
Систематична назва кукурбіт[6]урила є Додекагідро-1Н, 4Н, 14Н, 17Н-2, 16:3, 15-диметано-5Н, 6Н, 7Н, 8Н, 9Н, 10Н, 11Н, 12Н, 13Н, 18Н, 19Н, 20H, 21H, 22H, 23H, 24H, 25H, 26H-2, 3, 4a, 5a, 6a, 7a, 8a, 9a, 10a, 11a, 12a, 13a, 15, 16, 17a, 18a, 19a, 20a, 21а, 22а, 23а, 24а, 25а, 26а-тетракозаазабіспенталено[1'', 6'':5'', 6'', 7'']циклоокти[1'', 2'', 3'':3', 4']пенталено(1', 6':5, 6, 7) -циклоокта (1, 2, 3-gh:1', 2', 3'-g'h ') циклоокта (1, 2, 3-cd: 5, 6, 7-c'd ') дипентален-1, 4, 6, 8, 10, 12, 14, 17, 19, 21, 23, 25-додекон.[25]
Remove ads
Примітки
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads