Топ питань
Часова шкала
Чат
Перспективи
Оксалілхлорид
хімічна сполука З Вікіпедії, вільної енциклопедії
Remove ads
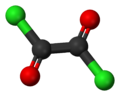
Оксалілхлорид — органічна хімічна сполука з формулою (COCl)2. Безбарвна рідина з різким запахом, диацилхлорид щавлевої кислоти, є популярним реагентом в органічному синтезі[3].
Remove ads
Одержання
Оксалілхлорид вперше був одержаний у 1892 році французьким хіміком Адрієном Фоконьє, реакцією діетилоксалату з пентахлоридом фосфору[4]. Його також одержують шляхом обробки щавлевої кислоти пентахлоридом фосфору[5].
Оксалілхлорид промислово виробляють з етиленкарбонату. Фотохлорування дає тетрахлорид, який згодом розкладається:
- C2H4O2CO + 4 Cl2 → C2Cl4O2CO + 4 HCl
- C2Cl4O2CO → C2O2Cl2 + COCl 2
Реакції
Оксалілхлорид реагує з водою, утворюючи лише газоподібні продукти: хлористий водень (HCl), вуглекислий газ (CO 2 ) і оксид вуглецю (CO).
- (COCl)2 + H2O → 2 HCl + CO2 + CO
Цим він значно відрізняється від інших ацилхлоридів, які гідролізуються з утворенням хлористого водню та вихідної карбонової кислоти .
Застосування в органічному синтезі
Узагальнити
Перспектива
Окислення спиртів
Розчин, що містить ДМСО та оксалілхлорид, з подальшим додаванням триетиламіну перетворює спирти на відповідні альдегіди та кетони за допомогою процесу, відомого як окиснення Сверна[6][7][8].
Синтез ацилхлоридів
Оксалілхлорид зазвичай використовується N, N -диметилформамідом як каталізатором в органічному синтезі для одержання ацилхлоридів з відповідних карбонових кислот. Подібно до тіонілхлориду, у цій реакції реагент розкладається на леткі побічні продукти, що спрощує обробку. Одним із другорядних побічних продуктів реакції, що каталізується N,N-диметилформамідом, є сильний канцероген, що виникає внаслідок розкладання N,N-диметилформаміду[9]. Порівняно з тіонілхлоридом оксалілхлорид має тенденцію бути більш м’яким і селективнішим реагентом. Він також дорожчий, ніж тіонілхлорид, тому його, як правило, використовують у менших масштабах.
Ця реакція включає перетворення ДМФА в похідне імідоїлхлориду (Me2N=CHCl+), схоже на першу стадію в реакції Вільсмаєра–Хака. Імідоілхлорид є активним хлоруючим агентом.
Формілювання аренів
Оксалілхлорид реагує з ароматичними сполуками в присутності хлориду алюмінію з утворенням відповідного ацилхлориду в процесі, відомому як ацилювання Фріделя-Крафтса[10][11]. Одержаний ацилхлорид можна гідролізувати з утворенням відповідної карбонової кислоти.
Одержання оксалатних діефірів
Як і інші ацилхлориди, оксалілхлорид реагує зі спиртами з утворенням естерів:
- 2 RCH2OH + (COCl)2 → RCH2OC(O)C(O)OCH2R + 2 HCl
Як правило, такі реакції проводять у присутності основи, такої як піридин. Діефір, отриманий з фенолу, ефір фенілового оксалату, є ціалумом, активним інгредієнтом світлових паличок.
Інше
Повідомляється, що оксалілхлорид був використаний у першому синтезі діоксантетракетону (C4O6), оксиду вуглецю[12].
Запобіжні заходи
У березні 2000 року Airbus A330-300 авіакомпанії Malaysia Airlines отримав пошкодження, які не підлягали ремонту, після витоку забороненого для перевезення оксалілхлориду (помилково декларованого як гідроксихінолін) у вантажний відсік[13]. Він токсичний при вдиханні, хоча більш ніж на порядок менш токсичний, ніж споріднена сполука фосген[14].
Див. також
- Оксаліл
- Окислення Сверна
Примітки
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads