Топ питань
Часова шкала
Чат
Перспективи
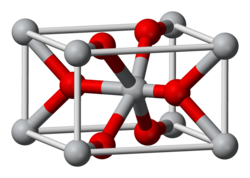
Оксид марганцю(IV)
хімічна сполука З Вікіпедії, вільної енциклопедії
Remove ads
Окси́д ма́рганцю (IV), ма́нган(IV) окси́д — неорганічна сполука, оксид складу MnO2. Являє собою порошок темно-коричневого або чорного кольору, нерозчинний у воді. Проявляє слабкі амфотерні властивості (із перевагою осно́вних).
Найстійкіша сполука марганцю, широко поширена в земній корі. Зустрічається у вигляді мінералів піролюзиту, криптомелану, псиломелану, рамзделіту.
Remove ads
Поширення у природі

Оксид марганцю зустрічається у природі у вигляді чотирьох кристалічних різновидів, а саме: мінералів піролюзиту, криптомелану, псиломелану та рамзделіту. Суттєво переважає у розповсюдженості піролюзит.
Фізичні властивості
Оксид марганцю являє собою чорний парамагнітний порошок амфотерного характеру. При нагріванні вище 535 °C сполука розкладається.
Штучно було створено п'ять різних кристалічних структур оксиду марганцю: α-, β-, γ-, ε- і δ-MnO2. α-Модифікація відповідає структурі мінералу криптомелану, β-форма — піролюзиту, γ-MnO2 — рамзделіту. ε- та δ-форми не мають природних відповідників.
Отримання
Узагальнити
Перспектива
Оксид марганцю можна синтезувати прокалюванням на повітрі деяких оксигеновмісних солей Mn(II):
У лабораторних умовах MnO2 отримують термічним розкладанням перманганату калію.
Також можна отримати реакцією перманганату калію з пероксидом водню.
Аналогічно застосовується метод окиснення сполук Mn(II) у лужних (рідше нейтральних) розчинах:
Солі Mn(IV) гідролізуються з утворенням осаду MnO2:
При температурі вище 100 °C перманганат калію відновлюється воднем:
Remove ads
Хімічні властивості
Узагальнити
Перспектива
За звичайних умов оксид марганцю поводиться досить інертно. При прокалюванні на повітрі MnO2 розкладається до Mn2O3, а за вищої температури — до Mn3O4:
При нагріванні з кислотами виявляє окисні властивості, наприклад, окислює концентровану соляну кислоту до хлору (даний метод використовується в лабораторії для синтезу хлору):
З сірчаною і азотною кислотами MnO2 розкладається з виділенням кисню:
При взаємодії з сильними окисниками діоксид марганцю окислюється до сполук Mn+7 та Mn+6:
MnO2 проявляє амфотерні властивості. Він реагує з концентрованими лугами:
При сплавленні з осно́вними оксидами MnO2 виступає в ролі кислотного оксиду, утворюючи солі манганіти:
Під дією водню, коксу або оксиду вуглецю сполука може відновлюватися до металу або MnO:
Оксид марганцю є каталізатором розкладання пероксиду (перекису) водню:
Remove ads
Застосування
Оксид марганцю застосовується у виготовленні скла: його добавки усувають зелене забарвлення, спричинене наявністю силікату заліза(II), а також надають відтінок від рожевого до чорного, в залежності від об'ємів добавки. Тонкий дисперсний порошок або колоїд MnO2 використовується як адсорбент хлору, діоксиду сірки, солей барію, радію, срібла, алюмінію та калію.
Оксид застосовується як деполяризатор в елементах Лекланше (наприклад, у вугільно-цинкових батареях).
Remove ads
Див. також
Джерела
- CRC Handbook of Chemistry and Physics (86th ed.) / D. R. Lide, ed. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- Ахметов Н. С. «Общая и неорганическая химия» М.:Высшая школа, 2001
- Неорганическая химия под редакцией Ю. Д. Третьякова; Химия переходных элементов Кн.1
- Рипан Р., Чертяну И. Неорганическая химия: Химия металлов: В 2 т. / Под ред. В. И. Спицына. — М. : Изд. «Мир», 1972. — Т. 2. — 871 с. (рос.)
- Реми Г. Курс неорганической химии: в 2 т. / Пер. с нем., под ред. А. В. Новоселовой. — М. : ИИЛ,1966. — Т. 2. — 833 с. (рос.)
- Химические свойства неорганических веществ: Учеб. пособие для вузов. 3-е изд., испр. / Лидин Р. А., Молочко В. А., Андреева Л. Л.; Под ред. Лидина Р. А. — М. : Химия, 2000. — 480 с. — ISBN 5-7245-1163-0. (рос.)
Remove ads
Посилання
- Двооксид марганцю // Універсальний словник-енциклопедія. — 4-те вид. — К. : Теза, 2006.
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads