Топ питань
Часова шкала
Чат
Перспективи
Перхлоратна кислота
хімічна сполука З Вікіпедії, вільної енциклопедії
Remove ads
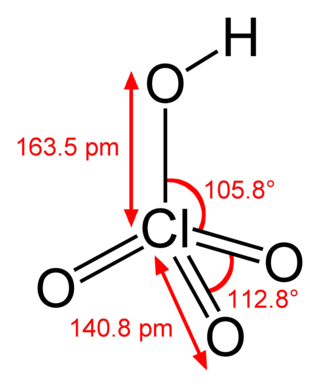
Перхлора́тна кислота́ (HClO4) — найсильніша одноосновна кислота (у водному розчині), безводна — сильний окисник. Вибухонебезпечна. Перхлоратну кислоту та її солі (перхлорати) застосовують як окисники.
Remove ads
Історія
Перше повідомлення про синтез перхлоратної кислоти міститься у статті Ф. Стадіона[4], який у 1816 році отримав її шляхом перегонки продукту, що утворюється при обережному плавленні хлорату калію в суміші з концентрованою сульфатною кислотою. Ф. Стадіон здійснив важливий внесок у дослідження перхлоратної кислоти не тільки як першовідкривач, а й як дослідник, який вперше отримав її електролізом розчину діоксиду хлору[en] [5]. Пізніше О. Генрі запропонував отримувати перхлоратну кислоту, виходячи з перхлорату калію, оксиду цинку і гексафторсилікатної кислоти[en][6].
Спосіб Ф. Стадіона був значно спрощений і покращений Натівелем[7].
Remove ads
Властивості
Узагальнити
Перспектива
Безбарвна летюча рідина, сильно димить на повітрі, в парах існує у вигляді мономеру. Безводна перхлоратна кислота дуже реакційноздатна та нестійка. Рідка HClO4 частково димеризована. Характерною є для неї рівноважна автодегідратація:
- 3HClO4 ↔ H3O+ + ClO−
4 + Cl2O7
HClO4 добре розчинна у хлорорганічних розчинниках, таких, як CF3COOH, CHCl3, CH2Cl2 та ін. Змішування з розчинниками, які проявляють відновні властивості, може призвести до займання та вибуху. З водою перхлоратна кислота змішується в будь-яких співвідношеннях і утворює ряд гідратів HClO4 × nH2O (де n = 0,25 … 4). Моногідрат HClO4 • H2O має високу температуру плавлення (+50 °С). Концентровані розчини перхлоратної кислоти, на відміну від безводної кислоти, мають маслянисту консистенцію. Водні розчини HClO4 стійкі, мають низьку окисну здатність. Перхлоратна кислота з водою утворює азеотропну суміш, киплячу при 203 °C і містить 72% HClO4. Розчини перхлоратної кислоти в хлорвмісних вуглеводнях є суперкислотами. HClO4 є однією з найсильніших неорганічних кислот, в її середовищі навіть кислотні сполуки ведуть себе як основи, приєднуючи протон і утворюючи катіони ацилперхлоратів: P(OH)+
4, ClO4−, NO+
2, ClO−
4. При слабкому нагріванні та при зниженому тиску суміші перхлоратної кислоти з фосфорним ангідридом, відганяється безбарвна масляниста рідина — хлорний ангідрид:
- 2HClO4 + P2O5 → Cl2O7 + 2HPO3
Солі перхлоратної кислоти називаються перхлорати.
Remove ads
Отримання
- Водні розчини перхлоратної кислоти отримують електрохімічним окисненням соляної кислоти або хлору, розчинених у міцній перхлоратній кислоті, а також обмінним розкладанням перхлоратом натрію або калію сильними неорганічними кислотами.
- Безводна перхлоратна кислота виходить при взаємодії перхлоратом натрію або калію з міцною сірчаною кислотою, а також водних розчинів перхлоратної кислоти з олеумом:
- KClO4 + H2SO4 → KHSO4 + HClO4
Застосування
- Концентровані водні розчини перхлоратної кислоти широко використовуються в аналітичній хімії, а також для отримання перхлоратів.
- Перхлоратна кислота застосовується при розкладанні складних руд, при аналізі мінералів, а також як каталізатор.
- Солі перхлоратної кислоти: перхлорат калію|перхлорат калію KClO4 малорозчинні у воді, застосовується у виробництві вибухових речовин, перхлорат магнію Mg(ClO4)2 (ангідрон) — осушувач. Суху перхлоратну кислоту не можна довго зберігати і перевозити, тому що при зберіганні в звичайних умовах вона повільно розкладається, забарвлюється оксидами хлору, що утворюються при її розкладанні, і може мимоволі вибухати.
Remove ads
Див. також
Література
- Глосарій термінів з хімії // Й.Опейда, О.Швайка. Ін-т фізико-органічної хімії та вуглехімії ім. Л.М.Литвиненка НАН України, Донецький національний університет — Донецьк: «Вебер», 2008. — 758 с. — ISBN 978-966-335-206-0
Примітки
Джерела
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads