Топ питань
Часова шкала
Чат
Перспективи
Хлорофіл
З Вікіпедії, вільної енциклопедії
Remove ads
Хлорофіл — зелений пігмент, наявний у клітинах рослин, деяких водоростей і ціанобактерій, що надає їм відповідного кольору. Назва походить від грец. chloros — «зелений» і phyllon — «листок». Зареєстрований як харчовий барвник під номером E140.
Remove ads
Історія
Вперше з листя виділили зелену речовину й назвали її хлорофілом французькі хіміки-фармацевти Ж. Пельт'є та Ж. Каванту 1817 року. Це відкриття було зроблено випадково у процесі пошуку лікарських засобів у різних рослинах. У кристалічному вигляді хлорофіл вперше був отриманий російським фізіологом й ботаніком Іваном Бородіним 1882 року. Польські біохіміки Марцелл Ненцький й Леон Мархлевський у 1887 році показали, що основу молекули хлорофілу складає порфінове кільце. Елементний склад хлорофілу a — C55H72N4O5Mg та b — C55H70N4O6Mg був визначений у 1914 році німецьким хіміком Ріхардом Вільштеттером. Він не лише виділив хлорофіл а й хлорофіл b, та встановив їх хімічний склад, але також довів, що у всіх рослин, незалежно від умов їх знаходження, хлорофіл є однаковим. За ці дослідження Р. Вільштеттер у 1915 році був нагороджений Нобелівською премією з хімії.[3]
У 1960 році хіміки-органіки Р. Б. Вудворд й М. Штрель завершили повний синтез молекули хлорофілу й підтвердили правильність структурної формули, встановленої Г. Фішером.
Remove ads
Хімічна структура
Узагальнити
Перспектива
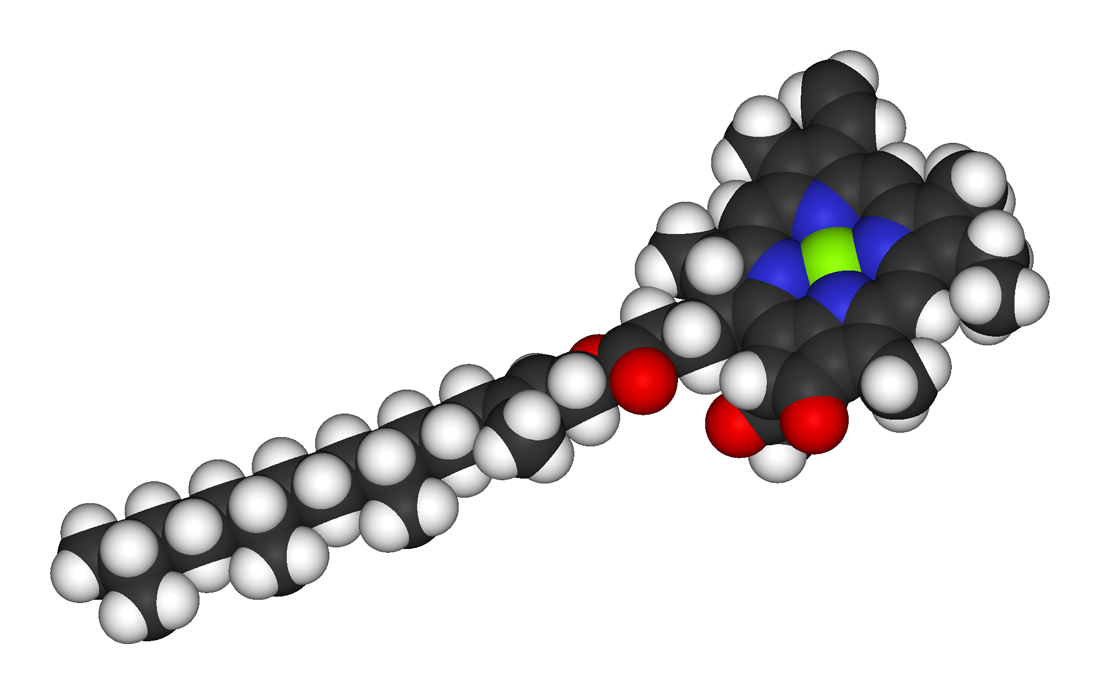
Молекула хлорофілу складається з порфінової «головки» й фітольного «хвоста». При цьому порфінова частина молекули знаходиться на поверхні мембрани тилакоїда й пов'язана із білками, а жиророзчинний фітольний ланцюг занурений у ліпідний шар. Хлорофіл є складним етером дикарбонової кислоти хлорофіліну, у якої одна карбоксильна група етерифікована залишком метилового спирту, а друга — залишком спирту фітолу. За розриву складноетерного зв'язку й відщеплення фітолу утворюється сполука, яка називається хлорофілідом.
 |
 |
Remove ads
Основні властивості
Узагальнити
Перспектива

Основу молекули хлорофілу складає кільце з 4 піролів, пов'язаних йоном магнію. У хлорофілів a, b, d є довгий фітольний ланцюг, який є відсутнім у хлорофілів с. Пластиди водоростей з різних відділів відрізняються за складом хлорофілів. Наприклад, глаукоцистофітові, червоні й евстігматофіцієві (Eustigmatophyceae) водорості містять лише хлорофіл а, зелені, евгленові й хлорорахніофітові містять хлорофіли а та b. Інші відділи еукаріотних водоростей містять хлорофіли а й c. В усіх фотосинтезуючих прокаріотичних водоростей присутній хлорофіл а, хлорофіли b, c зустрічаються у прохлорофтів, хлорофіл d виявлений лише у Acaryochloris marina.

Розрізняють головні хлорофіли, які разом із бета-каротином входять до складу реакційних центрів, і допоміжні, які входять у світлопоглинаючі антени. Головним хлорофілом у всіх фотосинтезуючих водоростей є хлорофіл а. Винятком є Acaryochloris marina, у якого до складу реакційного центру входить хлорофіл d. До складу антенних систем входять хлорофіли b та с. Хлорофіл бере участь у передачі енергії від каротиноїдів до хлорофілу а у антенних комплексах[4].
Хлорофіли, як й фікобіліни, відносяться до тетрапіролів, які, на відміну від фікобілінів, замкнені у кільце (фікобіліни ж розташовані лінійно).
Хлорофіл і фотосинтез
Хлорофіл забезпечує перетворення енергії світла на енергію хімічних зв'язків. Хлорофіли мають два максимуми поглинання світла — у синій (430–460 нм) й червоній (650–700 нм) областях спектру.
Синьо-фіолетовий максимум поглинання хлорофілів забезпечується резонансною структурою порфінового кільця. Поглинання світла у червоній області спектра пов'язане із наявністю магнію й гідруванням подвійного зв'язку у положення С7-С8 D-пірольного ядра. Тому у феофітінуу (через втрату атому Mg) червоний максимум виражений слабкіше. Положення максимумів поглинання світла хлорофілом залежить від природи розчинника, взаємодії молекул пігментів одна з одною, з біпідами та білками. Хлорофіли асоційовані із гідрофобними білками й вбудовані у ліпідну фазу мембрани тилакоїда.
Хлорофіл є сенсибілізатором — легко збуджується при поглинанні світла й має здатність передавати енергію (є донором енергії) іншим молекулам (акцепторам енергії). Збуджена світлом молекула хлорофілу набуває здатності брати участь у окисно-відновних процесах, тобто віддавати й приймати електрони.
У анаеробних умовах хлорофіл, розчинений у піридині, під дією світла відновлюється аскорбіновою кислотою або іншими донорами електронів. Після вимкнення світла реакція йде у зворотному напрямку:
Своєю чергою «фотовідновлений» хлорофіл може відновлювати такі акцептори, як НАД+, хінони, Fe3+ тощо:
Ці реакції отримали назву реакцій Красновського.[5]
При обробці рослин бензиламінопурином підвищується вміст зеатину й ауксинів й понижується рівень абсцизової кислоти. Відношення зеатин/абсцизова кислота зростає. На цьому фоні спостерігається збільшення вмісту у листях пігментів (хлорофілу, каротиноїдів), розчинних вуглеводів. Це узгоджується із даними про впилв цитокінінів на біосинтез хлорофілу через посилене утворення попередника цього пігмента — протохлорофіліду[6].
Remove ads
Застосування
Препарати на основі хлорофілів
Похідні хлорофілу використовують у фармацевтиці як складники місцевих антисептичних засобів. «Хлорофіліпт» — суміш хлорофілів з листя евкаліпта (Eucalyptus spp.), що застосовується у формі спиртових та олійних розчинів; в Україні він зареєстрований як лікарський засіб місцевої дії проти інфекцій, спричинених стафілококами.[7][8] У Європейському Союзі препарати з листя евкаліпта класифікують як традиційні рослинні лікарські засоби із симптоматичними показаннями; доказова база ґрунтується переважно на тривалому досвіді застосування.[9] Описані у популярних виданнях схеми використання мають довідковий характер і не замінюють офіційні інструкції (приклад оглядової публікації з «меню застосувань»).[10]
Застосування у виробництві харчових продуктів
Барвник зареєстрований під номером E140 і дозволений для застосування у виробництві харчових продуктів за технологічною необхідністю.
В Україні барвник є в переліку дозволених харчових добавок[11].
Remove ads
Див. також
Примітки
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads