热门问题
时间线
聊天
视角
一氧化二氯
化合物 来自维基百科,自由的百科全书
Remove ads
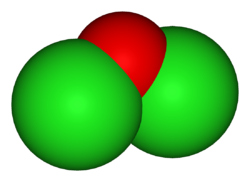
一氧化二氯是氯的氧化物之一,也是次氯酸的酸酐,化学式为Cl2O。它在1834年由安托万·巴拉尔首次合成,[4]之后盖-吕萨克确定了其化学组成。在室温下,一氧化二氯是可溶于水和有机溶剂的棕黄色气体,在液态下呈红棕色,在固态下则变成樱桃红色[1]。它是强氧化剂和氯化剂。
Remove ads
制备
一氧化二氯最早的制备方法是使氯气和氧化汞反应而成,[5]但此法成本昂贵,且因有汞中毒的风险而非常危险。
- 2 Cl2 + HgO → HgCl2 + Cl2O
一个较为安全方便的制备方法是使氯气和湿润的碳酸钠在20–30 °C下反应:[5]
氯气和无水碳酸钠也能反应,但需将反应温度提高到150–250 °C。由于一氧化二氯在高温下不稳定,[6]因此需要不断从反应体系中移去产物一氧化二氯来避免分解。
- 2 Cl2 + Na2CO3 → Cl2O + CO2 + 2 NaCl
结构
一氧化二氯的结构与水和次氯酸相似,都是角形分子。它的Cl-O键长为170.0 pm,Cl-O-Cl键角为110.9°。[7]这个键角比水和次氯酸大是两个氯原子的位阻效应导致的。
反应
一氧化二氯易溶于水,[9]并与HOCl达成平衡。
- 2 HOCl ⇌ Cl2O + H2O K (0 °C) = 3.55x10−3 dm3/mol
虽然一氧化二氯在平衡中处于劣势,但它才是饮水氯化中的活性物质。[10]
一氧化二氯可和金属卤化物反应,产生氯氧化物并放出Cl2。[11][12][5]
它和五氧化二氮反应,得到硝酸氯(ClNO3),[15]和三氟氧化氯反应则可以得到一氟化氯和氯酰氟。[16]一氧化二氯和氨的反应会爆炸,生成氮气、氯气和水。[1]
一氧化二氯与碱金属和碱土金属的氢氧化物溶液反应生成相应的次氯酸盐[1],而干燥的次氯酸盐可被一氧化二氯进一步氧化成氯酸盐。[1]
Remove ads
一氧化二氯是有效的氯化剂,可以把芳香化合物的侧链氯化[17],而和酚或芳香醚的反应则主要氯化芳香环。[18]它和醇反应会生成次氯酸酯,如和叔丁醇反应生成次氯酸叔丁酯。[19]一氧化二氯也是次氯酸和烯烃或芳香化合物的反应中的活性物质。[20][21]
一氧化二氯见光分解,产生O2和Cl2。这个反应是自由基反应,闪光光解表明一氧化氯(ClO·)是反应的主要中间体。[22]
- 2 Cl2O → 2 Cl2 + O2
一氧化二氯会爆炸,但对它的研究不充分。一氧化二氯的爆炸下限很高,达到23.5%,即它和氧气在室温下的混合物需要含有至少23.5% Cl2O才能被电火花引爆。[23]有研究称一氧化二氯在强光下会爆炸,但此研究有争议。[24][25]将一氧化二氯迅速加热或缓慢加热到120 °C都会使它爆炸。[5]液态一氧化二氯对冲击敏感。[26]
用处
一氧化二氯是生产次氯酸钙、氯代溶剂和氯代异氰尿酸盐的中间体。[1]它还用于漂白木浆和布[27],也是半导体工业的刻蚀剂。[28]
参考资料
延伸阅读
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads