热门问题
时间线
聊天
视角
四氯化铪
化合物 来自维基百科,自由的百科全书
Remove ads
四氯化铪,无机化合物,化学式HfCl4。这种无色固体是大多数有机铪化合物的前体。它可用于多种特定用途,主要集中于材料科学中,或作为催化剂。
Remove ads
制备
可以用几种相近的方法来制备HfCl4:
- HfO2 + 2 CCl4 → HfCl4 + 2 COCl2
- HfO2 + 2 Cl2 + C → HfCl4 + CO2
- HfC+2 Cl2→HfCl4+C
分离锆和铪
铪和锆通常共生于矿物中,如锆石、曲晶石和斜锆石。二氧化铪(HfO2)的含量在锆石中为0.05%至2.0%,曲晶石为5.5%至17%,斜锆石为1.0%至1.8%[8]。铪和锆的化合物会从矿石中一并提取,并转化为四氯化物的混合物。
HfCl4和ZrCl4难以分离,因为铪和锆的化合物具有非常相似的化学和物理性质。它们的原子半径相近:铪为156.4 pm,而锆为160 pm[9]。两种金属的反应相似,并会形成相似的配合物。
许多方法可从ZrCl4中提炼出HfCl4,包括分馏、分级沉淀、分级结晶和离子交换法。固体氯化铪的蒸气压(从476至681 K)的对数(以10为底数)由下式给出:log10(P) = -5197/T + 11.712,其中压力的单位为托,温度的单位为开尔文。(熔点下的压力为23000托。)[10]
有一种方法基于两种四卤化物还原性的差异[8]。选择性地将锆化合物还原一至二价,甚至是单质,可以分离四卤化物。在还原反应中,四氯化铪基本不反应,并且可从直接从锆的低卤化物中回收。四氯化铪是挥发性的,因此可以很容易地从不挥发的三卤化锆中分离出来。
Remove ads
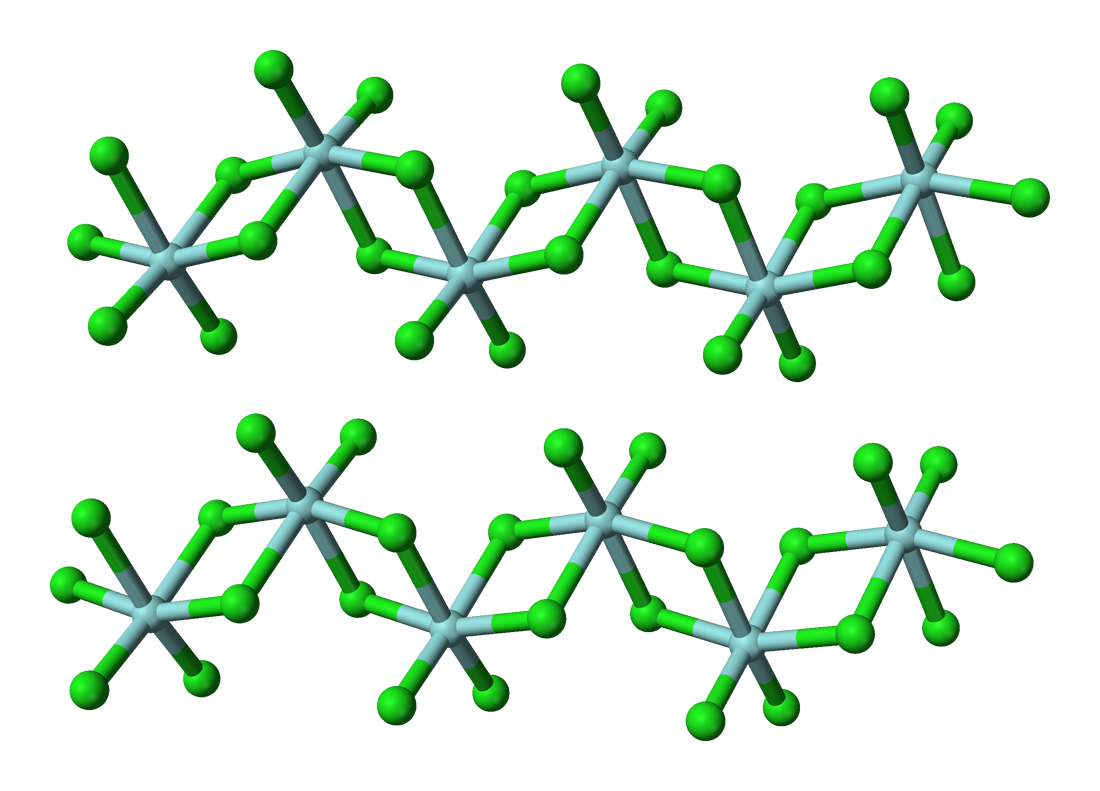
结构及成键
此卤化物含有+4氧化态的铪。固体HfCl4是八面体铪中心聚合物。每个铪中心周围有六个氯配体,二个为终端,四个桥接至另一个铪中心。在气相中,ZrCl4和HfCl4有着与TiCl4相同的单体四面体结构[11]。气相HfCl4的电子成相研究显示,Me-Cl核间距为2.33 Å,Cl…Cl核间距为3.80 Å。核间距比r(Me-Cl)/r(Cl…Cl)为1.630,与正四面体模型的预测值(1.633)很接近[9]。
反应特性
该化合物极易水解,并释放氯化氢:
- HfCl4 + H2O → HfOCl2 + 2 HCl
因而,久置的样品中常常混有氯氧化物,它也是无色的。
- HfCl4 + 2 OC4H8 → HfCl4(OC4H8)2
因为此配合物可溶于有机溶剂,它是一种制备铪的其他配合物的有用试剂。
与醇形成醇盐。
- HfCl4 + 4 ROH → Hf(OR)4 + 4 HCl
这些化合物结构复杂。
HfCl4极难还原。在膦配位体的存在下,可以用钠钾合金还原[13]:
- 2 HfCl4 + 2 K + 4 P(C2H5)3 → Hf2Cl6[P(C2H5)3]4 + 2 KCl
用途
四氯化铪是高活性的齐格勒-纳塔催化剂的前体,用于烯烃,特别是丙烯的聚合中[14]。典型的催化剂由四苄基铪衍生而来。
在各种有机合成应用中,HfCl4是一种高效的路易斯酸。例如,相比使用氯化铝,用四氯化铪能使二烯丙基氯硅烷更高效地烷基化二茂铁。大尺寸的Hf可以减小HfCl4与二茂铁配合的倾向。[15]
HfCl4可以加速1,3-偶极环加成,并对其加以控制[16]。与芳基和脂族醛肟一起使用时,相比其它路易斯酸,能得到更好的结果,并可生产外异构体。
HfCl4曾作为化学气相沉积和原子层沉积的一种前体,以生成二氧化铪和硅酸铪,它们在制造现代高密度集成电路时用作高κ电介质[17]。然而,由于其相对较低的挥发性和腐蚀性的副产物(即HCl),HfCl4为金属有机前体所淘汰,例如四(乙基甲基氨基)铪(TEMAH)[18]。
参考
扩展阅读
外部链接
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads