热门问题
时间线
聊天
视角
炭疽杆菌
细菌的种类,隶属于芽孢杆菌属,炭疽病的病原体 来自维基百科,自由的百科全书
Remove ads
炭疽芽孢杆菌[1](学名:Bacillus anthracis)简称炭疽杆菌、炭疽菌,是一种革兰氏阳性细菌,呈杆棒状,是导致炭疽病的病原体,对牲畜尤为致命,有时也会感染人类并对其造成伤亡,为人畜共患病。该菌属于芽孢杆菌属。[2] 1876年,德国医生罗伯特·科赫发现了这种细菌,并成为第一个经实验证实为病原体的细菌。这一发现也是细菌致病理论的第一个科学证据。[3]

炭疽杆菌长约3至5微米,宽约1至1.2微米。基因组由一个5,227,419bp的环状染色体和两个染色体外脱氧核糖核酸(DNA)质粒组成,pXO1和pXO2分别长约181,677bp和94,830bp,[4]其亦是导致致病性的因素。该菌会形成一层为内生孢子的保护层,使其能够保持多年不活跃状态,并在合适的环境条件下突然变得具有感染力,例如内生孢子在土壤中,会进入休眠状态,一旦由牲畜摄入,菌芽孢便开始在动物体内大量复制,最后造成死亡,随后于尸体中仍能继续繁殖,而当细菌将宿主养分用尽,又将重回芽孢并进入睡眠态。由于内孢子的韧性,该菌被用于生物武器。细菌的蛋白质荚膜(聚-D-γ-谷氨酸)是逃避免疫反应的关键。它利用两种分泌性铁载体/铁结合物蛋白IsdX1和IsdX2,以血液蛋白血红蛋白中的血红素为食。

未经治疗的炭疽杆菌感染通常是致命的。感染表现为炎症、黑色、坏死性病变(焦痂)。溃疡通常出现在面部、颈部、手臂或手部。致命症状包括流感样发烧、胸部不适、出汗过多和身体疼痛。第一种动物炭疽疫苗是由法国化学家路易·巴斯德于1881年研制的。目前已有多种动物和人类疫苗可用。该感染可用常见抗生素治疗,例如青霉素、喹诺酮类和四环素类抗生素。
Remove ads
描述

炭疽杆菌是一种杆状细菌,长约3至5微米,宽约1至1.2微米。[5] 当在培养中生长时,它们往往会形成长链细菌。在琼脂平板上,它们形成几毫米宽的大菌落,通常呈白色或奶油色。[5] 大多数炭疽杆菌菌株都会产生荚膜,使菌落呈现粘稠的粘液状外观。[5]
它是已知的少数几种能够合成弱免疫原性和抗吞噬性蛋白质荚膜(聚-D-γ-谷氨酸)的细菌之一,这种蛋白质荚膜可以将营养细菌隐藏在宿主免疫系统的视野中。[6] 大多数其他细菌物种的荚膜由多糖荚膜包裹,而非聚-γ-D-谷氨酸,这为炭疽芽孢杆菌提供了进化优势。多糖与中性粒细胞分泌的防御素粘附有关,这些防御素可灭活并降解细菌。由于荚膜中不含有这种大分子,炭疽芽孢杆菌可以逃避中性粒细胞的攻击并继续传播感染。荚膜成分的差异也很重要,因为据推测聚-γ-D-谷氨酸会产生负电荷,从而保护细菌的营养期免受宿主巨噬细胞的吞噬。[7] 荚膜降解为较低的分子量并从细菌细胞表面释放出来,作为诱饵保护细菌免受宿主补体系统攻击。[8]
与百日咳博德特氏菌(Bordetella pertussis)类似,它会形成一种依赖钙调蛋白的腺苷酸环化酶外毒素,即炭疽水肿因子(炭疽毒素)以及炭疽致死因子内肽酶。它在基因型和表型上与蜡样芽孢杆菌和苏云金芽孢杆菌非常相似。这三个物种具有相同的细胞尺寸和形态。它们均在位于未肿胀的孢子囊中央形成椭圆形孢子。炭疽杆菌的内孢子具有很强的适应能力,能够在极端温度、低营养环境和严酷化学处理下存活数十年甚至数百年。
内生孢子是一种脱水细胞,具有厚壁和细胞膜内形成的附加层。它可以保持多年不活动状态,但如果遇到适宜的环境,就会再次开始生长。它最初在杆状结构内发育。内生孢子在杆状结构内的位置、大小和形状,以及是否会导致杆状结构壁凸出,是某些芽孢杆菌属物种的特征。根据物种不同,内生孢子的形状有圆形、椭圆形,有时也有圆柱形。它们具有高度折射性,并含有皮考啉二酸(吡啶-2,6-二羧酸)。电子显微切片显示,它们具有较薄的内孢子外壳、较厚的孢子皮层和包裹内孢子内容物的内部孢子膜。内孢子耐热、耐干燥,并耐多种消毒剂(包括95%乙醇)。[9] 由于这些特性,炭疽杆菌内孢子非常适合用作(以粉末和气雾剂形式)生物武器。过去至少有五个国家的生物武器项目实现了此类武器化,分别是:英国、日本、美国、俄罗斯和伊拉克,并且其他几个国家也曾尝试过。[10]
Remove ads
基因组结构
炭疽杆菌具有一条染色体,该染色体是一个环状DNA分子,由5,227,293个碱基对组成。[11] 它还包含两个环状、染色体外双链DNA质粒:pXO1和pXO2。pXO1和pXO2质粒均为其该菌毒力所必需的,代表了两个不同的质粒家族。[12]
Remove ads
pXO1质粒(182kb)包含编码炭疽毒素成分的基因:pag(保护性抗原,protective antigen,缩写:PA)、lef(致死因子,lethal factor,缩写:LF)和cya(水肿因子,edema factor,缩写:EF)。这些因子位于质粒上一个44.8kb的致病岛/毒力岛(pathogenicity island,缩写PAI)内。致死因子毒素是PA和LF的组合,而水肿因子毒素是PA和EF的组合。PAI还包含编码转录激活因子AtxA和阻遏蛋白PagR的基因,这两个基因均调控炭疽毒素基因的表达。[12]
pXO2编码一个由五个基因组成的操纵子 (capBCADE),该操纵子负责合成聚-γ-D-谷氨酸(聚谷氨酸盐)荚膜。该荚膜使炭疽杆菌能够通过保护自身免受吞噬作用而逃避宿主免疫系统的攻击。荚膜操纵子的表达由位于pXO2致病岛(35kb)上的转录调控因子AcpA和AcpB激活。pXO1中的AtxA控制AcpA和AcpB的表达。[12]
菌株
已知的89种炭疽杆菌菌株包括:
- 斯特恩菌株(Sterne strain) (34F2;又名“韦布里奇菌株”〔Weybridge strain〕),马克斯·斯特恩(Max Sterne)在1930年代研发的疫苗中使用过
- 沃勒姆/沃伦菌株,曾被美国、英国和伊拉克武器化;1935年从英国牛津郡的一头牛身上分离出来
- 沃勒姆M-36,英国研究用的强毒株;在猕猴体内传播了36次
- 沃勒姆1B,美国和英国在20世纪40年代至60年代将其武器化
- 沃勒姆-14578,用于1942年英国生物武器试验,严重污染了格林亚德岛
- V770-NP1-R,用于生物炭疽(BioThrax)疫苗的无毒无荚膜菌株
- 炭疽836(Anthrax 836)是一种剧毒菌株,被苏联武器化;1953年在基洛夫州基洛夫发现
- 1981年从德克萨斯州一头牛身上分离出来的埃姆斯毒株;因在2001年美国炭疽信件攻击中被使用而出名。
- 祖先埃姆斯菌(Ames Ancestor)
- 佛罗里达埃姆斯菌(Ames Florida)
- H9401,从韩国人患者中分离出来;用于研究炭疽疫苗[13]
Remove ads
进化
全基因组测序使得炭疽杆菌系统发育的重建极其重要和准确。促成重建的一个因素是炭疽杆菌的单态性,这意味着其遗传多样性较低,包括自其作为一个物种衍生以来缺乏任何可测量的DNA横向转移。多样性的缺乏是由于其进化史较短,导致单核苷酸多态性突变饱和度较低。[14]
进化时间短并不一定意味着时间顺序短。DNA复制时会发生错误,从而导致基因突变。这些突变随着时间的推移不断积累,最终导致物种进化。在炭疽杆菌的生命周期中,它会在土壤孢子库阶段度过相当长的时间,而此时DNA复制不会发生。这些漫长的休眠期大大降低了生物体的进化速度。[14]
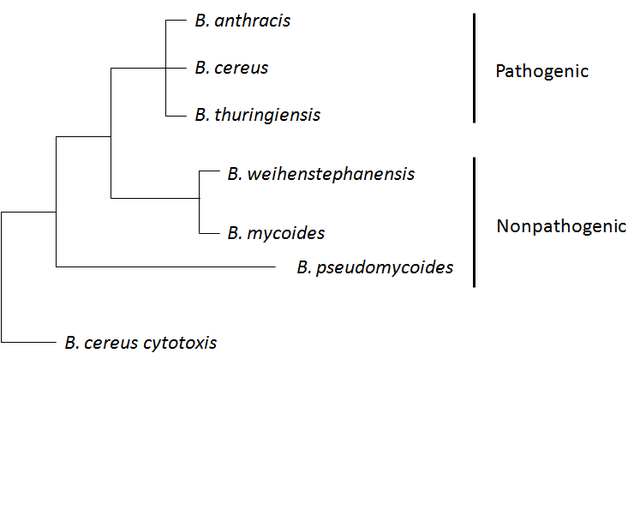
炭疽芽孢杆菌属于蜡样芽孢杆菌组,该组包含以下菌株:蜡样芽孢杆菌、炭疽芽孢杆菌、苏云金芽孢杆菌、韦施泰凡芽孢杆菌、蕈状芽孢杆菌和假蕈状芽孢杆菌。前三种菌株对昆虫或哺乳动物具有致病性或机会性,而后三种菌株不被认为具有致病性。该组的菌株在遗传和表型上总体上存在异质性,但其中一些菌株的亲缘关系更密切,并且在染色体水平上存在系统发育混合。蜡样芽孢杆菌组通常具有复杂的基因组,并且大多数菌株携带不同数量的质粒。[12]
蜡状芽孢杆菌是一种土壤细菌,可以作为共生体在无脊椎动物的肠道中定殖[15] 该菌也是食物中毒的常见原因。[16] 它会产生催吐毒素、肠毒素和其他毒力因子。[17] 肠毒素和毒力因子编码在染色体上,而催吐毒素编码在270kb质粒pCER270上。[12]
苏云金芽孢杆菌是一种微生物病原体,其特征是产生杀虫毒素Cry和Cyt的伴孢体/伴孢晶体。[18] 编码这些蛋白质的基因通常位于质粒上,而这些质粒可能会从生物体中丢失,从而使其与蜡样芽孢杆菌难以区分。[12]
蜡样芽孢杆菌进化枝的系统基因组学分析结合平均核苷酸同一性(average nucleotide identity,缩写:ANI)分析表明,炭疽芽孢杆菌物种还包括标注为蜡样和苏云金芽孢杆菌的菌株。[19]
Remove ads
PlcR是一个全局转录调控因子,控制着蜡样芽孢杆菌和苏云金芽孢杆菌中大部分分泌的毒力因子。它由染色体编码,遍布整个细胞。[20] 然而,在炭疽芽孢杆菌中,plcR基因在640位发生了一个碱基变化,这是一个无义突变,导致蛋白质功能失调。虽然1%的蜡状芽孢杆菌携带失活的plcR基因,但它们中没有一个携带仅在炭疽芽孢杆菌中发现的特定突变。[21]
plcR基因与papR基因共同构成一个双基因操纵子。[22][23] papR基因编码一种小蛋白质,该蛋白质从细胞中分泌出来,然后作为加工过的七肽重新导入,形成群体感应系统。[23][24] 炭疽芽孢杆菌缺乏PlcR蛋白,这是其区别于蜡样芽孢杆菌属其他成员的一个主要特征。蜡样芽孢杆菌和苏云金芽孢杆菌依赖plcR基因表达其毒力因子,而炭疽芽孢杆菌则依赖pXO1和pXO2质粒发挥其毒力。[12] 蜡样芽孢杆菌炭疽生物型变种,即具有两个质粒的蜡样芽孢杆菌,也能引起炭疽病。
Remove ads
临床方面
炭疽杆菌拥有抗吞噬荚膜,这对于其强毒性至关重要。该菌还产生三种质粒编码的外毒素:水肿因子,一种钙调蛋白依赖的腺苷酸环化酶,可导致细胞内环腺苷酸(cAMP)升高,并导致炭疽杆菌感染中常见的严重水肿;致死毒素,可导致组织坏死;以及保护性抗原,因其用于生产保护性炭疽疫苗而得名,它介导水肿因子和致死毒素进入细胞。
炭疽病的症状取决于感染类型,发病时间从1天到2个月以上不等。所有类型的炭疽病,如果不及时治疗,都有可能扩散至全身,导致严重疾病,甚至死亡。[25]
根据炭疽病的入侵门户,可将其分为四种类型。
- 皮肤型是最常见的类型(95%),会导致局部炎症性、黑色坏死性病变(焦痂)。溃疡通常出现在面部、颈部、手臂或手部。感染后1—7天内可能出现。
- 吸入型是一种罕见但极其致命的疾病,其特征是类似流感的症状、胸部不适、出汗和身体疼痛。[25] 通常发生在暴露一周后显现,但最多可能需要两个月的时间。
- 胃肠道型是一种罕见但致命的感染类型(导致25%的死亡),由摄入孢子引起。症状包括:发烧和发冷、颈部肿胀、吞咽疼痛、声音嘶哑、恶心和呕吐(尤其是呕血)、腹泻、眼睛潮红以及腹部肿胀。[25] 症状可能在1—7天内出现
- 注射性炭疽病的症状与皮肤炭疽病相似,但注射性炭疽病可以更快地扩散到全身,并且与皮肤炭疽病相比更难识别和治疗。[25] 症状包括发烧、发冷、病原体注射部位出现一团可能发痒的小肿块或水疱。水疱或肿块后出现中心呈黑色的无痛性溃疡。溃疡周围肿胀。病原体注射部位的皮下或肌肉深处出现脓肿。美国从未发现过此类病例。
Remove ads
目前已研发出多种用于预防牲畜和人类感染的炭疽疫苗。吸附炭疽疫苗可预防皮肤炭疽和吸入炭疽。然而,该疫苗仅适用于接触炭疽病前的高危成年人,尚未获准在接触炭疽病后使用。[26] 炭疽杆菌感染可用β-内酰胺抗生素如青霉素和其它对抗革兰氏阳性菌有效的药物治疗。[27] 耐青霉素的炭疽杆菌可用氟喹诺酮类药物(如环丙沙星)或四环素类抗生素(如多西环素)治疗。
实验室研究
茶中的成分,例如茶中的多酚,能够显著抑制炭疽杆菌及其毒素的活性;然而,孢子却不受影响。在茶中加入牛奶会完全抑制其对抗炭疽的抗菌活性。 [28] 在实验室中针对炭疽杆菌的活动并不能证明喝茶会影响感染过程,因为尚不清楚这些多酚如何在体内吸收和分布。炭疽杆菌可以在PLET琼脂上培养,这是一种专门用于选择炭疽杆菌的选择性鉴别培养基。
基因分型方法的进步使得对变异和关联性的遗传分析更加完善。这些方法包括多位点可变数目串联重复序列分析 (Multiple loci VNTR analysis,缩写:MLVA) 和基于典型单核苷酸多态性的分型系统。埃姆斯祖先菌染色体于2003年测序[11] 并有助于识别与炭疽杆菌毒力有关的基因。近期,韩国一名患有胃肠道炭疽病的患者体内分离出一株炭疽杆菌分离株H9401。韩国的目标是利用该菌株作为攻毒菌株,研发针对炭疽病的重组疫苗。 [13]
使用454 GS-FLX技术对韩国分离的H9401菌株进行测序,并使用多种生物信息学工具进行分析,以比对、注释和比较H9401与其他炭疽杆菌菌株。测序覆盖度表明,pXO1:pXO2:染色体的分子比为3:2:1,与埃姆斯佛罗里达菌株和埃姆斯祖先菌株相同。H9401与埃姆斯祖先的序列同源性为99.679%,氨基酸序列同源性为99.870%。H9401具有环状染色体(5,218,947 bp,预测5,480个 开放阅读框(ORF)),pXO1质粒(181,700 bp,预测202个ORF)和pXO2质粒(94,824 bp,预测110 个ORF)。[13] 与上述埃姆斯祖先染色体相比,H9401染色体约短8.5kb。由于H9401具有较高的致病性,且与埃姆斯祖先染色体序列相似,韩国将以H9401作为参考,用于测试候选炭疽疫苗的有效性。[13]
自从炭疽杆菌基因组测序以来,人们一直在探索对抗这种疾病的替代方法。细菌已经发展出多种策略来逃避免疫系统的识别。所有细菌都采用的主要逃避检测机制是分子伪装。外层细胞的细微修饰使细菌几乎无法被溶菌酶识别。[29] 其中三种修饰已被鉴定和表征。它们包括:(1) N-乙酰胞壁酸的N-糖基化,(2)N-乙酰胞壁酸的O-乙酰化,以及(3)N-乙酰葡萄糖胺的N-脱乙酰化。近年来的研究重点是抑制此类修饰。[30] 因此,人们正在研究多糖脱乙酰酶的酶促机制,该酶可催化从肽聚糖层的成分N-乙酰葡萄糖胺和N-乙酰胞壁酸中去除乙酰基。
宿主相互作用
与大多数其他致病细菌一样,炭疽杆菌必须获取铁才能在其宿主环境中生长繁殖。对于致病细菌来说,最容易获得的铁来源是宿主用于运输氧气的血红素基团。为了从宿主的血红蛋白和肌红蛋白中清除血红素,炭疽杆菌使用两种分泌性铁载体蛋白,IsdX1和IsdX2。这些蛋白可以将血红素从血红蛋白中分离出来,从而使炭疽杆菌的表面蛋白能够将其运送到细胞内。[31]
炭疽杆菌必须逃避免疫系统才能成功感染。炭疽杆菌孢子一旦进入宿主就会立即被巨噬细胞和树突状细胞吞噬。树突状细胞可以通过有效的细胞内消除来控制感染,但是巨噬细胞可以通过穿过一层薄薄的上皮细胞或内皮细胞将细菌直接运送到宿主体内,到达循环系统。[32]通常情况下,在吞噬过程中,病原体被巨噬细胞内化后会被消化。然而,炭疽芽孢并没有被降解,而是劫持了巨噬细胞的功能,逃避宿主免疫系统的识别。当吞噬细胞细胞外膜上的跨膜受体与孢子表面的分子相互作用时,炭疽杆菌孢子的吞噬作用就开始了。CD14是一种嵌入宿主膜的细胞外蛋白,它与炭疽芽孢杆菌外孢壁的糖蛋白BclA的鼠李糖 残基结合,从而促进整合素Mac-1由内向外的激活,增强巨噬细胞对孢子的内化。这种级联反应导致吞噬细胞激活并引发炎症反应。[33]
采样
可以通过在无孔表面采集的样本来确定炭疽杆菌的存在。
-
如何在无孔表面用纤维素海绵取样
-
如何使用大泡沫拭子(棉签)在无孔表面取样
历史背景

法国医生卡西米尔·达韦纳证明炭疽病的症状总是伴随着微生物炭疽杆菌。[34] 德国医生阿洛伊斯·波伦德因发现炭疽杆菌而受到赞誉。1876年,罗伯特·科赫证实炭疽杆菌是第一个能够致病的细菌。[35] 细菌的种加词“anthracis”来自希腊语“anthrax”(ἄνθραξ),意思是“煤”,指该疾病最常见的形式——皮肤型炭疽病,会形成大片黑色的皮肤病变。在整个19世纪,炭疽病是一种与医学发展密切相关的传染病。第一种含活菌的疫苗是路易·巴斯德发明的兽用炭疽疫苗。[36]
参阅
参考文献
延伸阅读
外部链接
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads