热门问题
时间线
聊天
视角
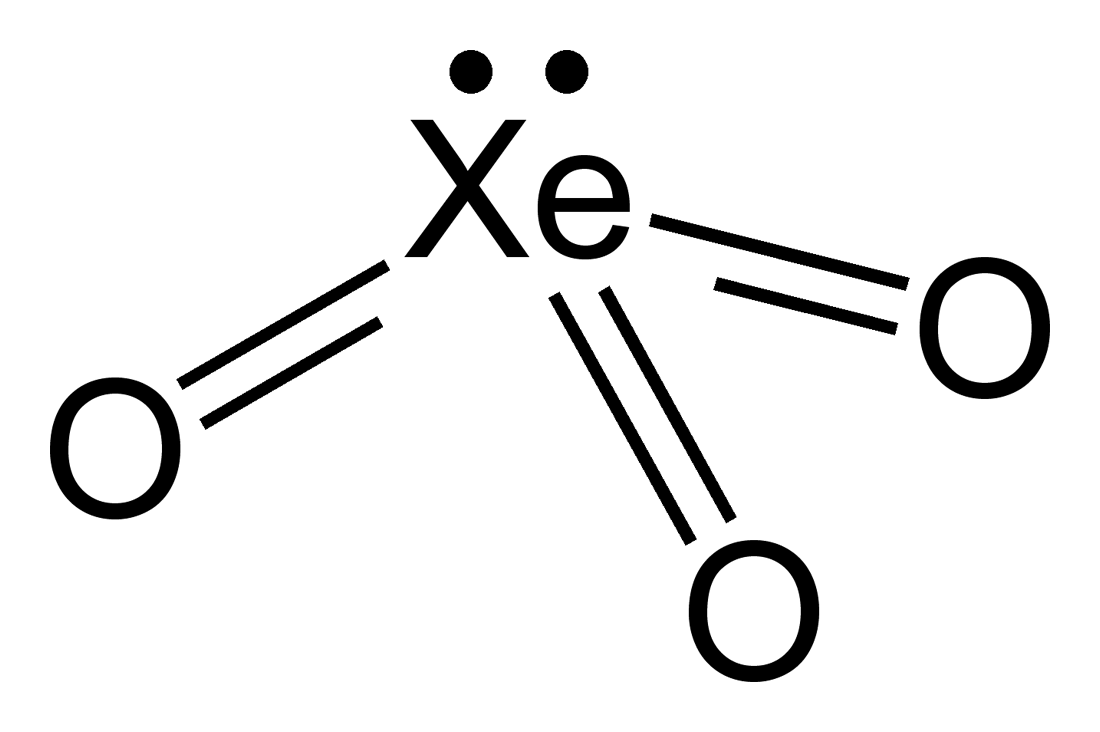
三氧化氙
化合物 来自维基百科,自由的百科全书
Remove ads
三氧化氙是一種不穩定的化合物,其中氙的化合價為+6。它是很強的氧化劑,會緩慢從水中釋放氧氣,暴露於陽光下會加速反應。它與有機化合物接觸時可能會爆炸。它爆炸時會釋放氙氣和氧氣。
Remove ads
化學性質
三氧化氙是一種強氧化劑,可以氧化大多數可以氧化的物質。然而,它的氧化反應緩慢,這降低了它的實用性。[2]
超過 25 °C時,三氧化氙非常容易發生劇烈爆炸:
當三氧化氙溶於水時,會產生酸性的氙酸溶液:
- XeO3(aq) + H2O → H2XeO4 ⇌ H+ + HXeO−
4
該溶液在室溫下穩定,沒有三氧化氙那樣的爆炸性。它可以將羧酸定量地氧化成二氧化碳和水。[3]
三氧化氙溶解在鹼性溶液中會形成氙酸鹽。HXeO−
4 陰離子是氙酸鹽溶液中的主要物種。[4]它們並不穩定,會歧化成高氙酸鹽(氧化態+8)和氙氣。[5] 含有 XeO4−
6 離子的高氙酸鹽可以通過 XeO
3 和氫氧化物溶液反應而成。三氧化氙和KF、RbF和CsF反應,形成通式為 MXeO
3F的化合物。[6]
物理性質
六氟化氙或四氟化氙的水解會產生三氧化氙溶液,通過蒸發可以得到無色的 XeO3 晶體。[7]這些晶體在乾燥空氣中可穩定數天,但容易從潮濕空氣中吸收水分,形成濃溶液。三氧化氙是正交晶系的,晶格參數 a = 6.163 Å、b = 8.115 Å和c = 5.234 Å。它的密度為 4.55 g/cm3。[8]
 |
 |

|
| XeO3晶體一部分的球棍模型 | 空間填充模型 | 氙原子的幾何配位 |
危險性
參考文獻
外部連結
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads