热门问题
时间线
聊天
视角
金屬蛋白
来自维基百科,自由的百科全书
Remove ads
金屬蛋白(英語:Metalloprotein)是一類含有配位結合的金屬離子作為輔因子的蛋白質[1][2]。所有蛋白質中有大量是屬於這一類。例如,儘管可能有多達3000種人類的鋅金屬蛋白質[3] ,但至少有1000種人類蛋白質(總數約20,000種)含有鋅結合的蛋白質結構域[4] 。

豐度
據估計,所有蛋白質中有大約一半含有金屬[5]。據另一個估計,大約四分之一到三分之一的所有蛋白質被提議要求有金屬執行其功能[6]。因此,金屬蛋白在細胞中具有許多種不同的功能,例如蛋白質的儲存和運輸,酶和信號轉導蛋白。金屬離子在感染性疾病中的作用已經被審查[7]。金屬結合蛋白的豐度可能是蛋白質使用的氨基酸所固有的,因為即使沒有進化史的人工蛋白質也很容易結合金屬[8]。
人體中的大多數金屬都與蛋白質結合。 例如,人體中鐵的相對較高濃度主要歸因於血紅蛋白中的鐵。
Remove ads
配位化學原理
金屬蛋白中的金屬離子一般是與多肽鏈上氨基酸殘基中的氮、氧或硫原子或與蛋白質相結合的大環配體相配位。由於金屬離子的特殊氧化還原性質,金屬酶常用作催化生氧化還原反應的催化劑。
除了由氨基酸殘基提供的供體基團外,許多有機輔因子還起配體的作用。 也許最著名的是併入血基質蛋白中的四齒N4大環配體。 無機配體如硫化物和氧化物也是常見的。
存儲與運輸相關的金屬蛋白
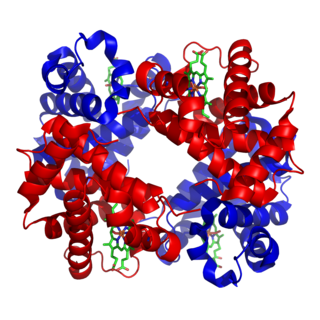
作為人類主要氧載體的血紅蛋白具有四個亞基,其中鐵(II)離子由平面大環配體原卟啉IX(PIX)和組氨酸殘基的咪唑氮原子配位。第六配位位點含有一個水分子或二氧分子。 相比之下,在肌肉細胞中發現的蛋白質肌紅蛋白只有一個這樣的單位。活性位點位於疏水口袋中。這是重要的,因為沒有它,鐵(II)將不可逆地氧化成鐵(III)。用於形成HbO2的平衡常數使得取決於肺中或肌肉中的氧氣體分壓而吸收或釋放氧。在血紅蛋白中,四個亞基顯示協同效應,其允許容易的氧從血紅蛋白轉移到肌紅蛋白[10]。
在血紅蛋白和肌紅蛋白中,有時都會錯誤地指出含氧物質含有鐵(III)。 現在已知這些物質的抗磁性是因為鐵(II)原子處於低自旋狀態。 在氧合血紅蛋白中,鐵原子位於卟啉環的平面內,而在順磁性脫氧血紅蛋白中,鐵原子位於環的平面上方[10]。 自旋態的這種變化是協同效應,這是由於氧合血紅蛋白部分中較高的晶體場分裂和較小的Fe2+離子的原子半徑。
蚯蚓血紅蛋白(Hemerythrin)是另一種含鐵的氧載體。氧結合位點是雙核鐵中心。
Remove ads
氧化和還原反應在有機化學中不常見,因為很少有機分子可以充當氧化劑或還原劑。另一方面,鐵(II)可以容易地被氧化成鐵(III)。這種功能用於細胞色素,其作為電子轉移載體。 金屬離子的存在允許金屬酶進行諸如氧化還原反應的功能,其不容易通過在氨基酸中發現的有限組的官能團來進行[11]。大多數細胞色素中的鐵原子包含在血紅素基團中。 這些細胞色素之間的差異在於不同的側鏈。 例如,細胞色素a具有血紅素A輔基,細胞色素b具有血紅素B輔基。這些差異導致不同的Fe 2+ / Fe 3+還原電位,使得各種細胞色素參與線粒體電子傳遞鏈[12]。

紅氧還蛋白是在硫代謝細菌和古菌中發現的電子載體。活性位點包含一個鐵離子,該鐵離子由四個半胱氨酸殘基的硫原子配位,形成幾乎規則的四面體。 紅氧還蛋白執行單電子轉移過程。 鐵原子的氧化狀態在+2和+3狀態之間變化。 在兩種氧化態下,金屬都是高自旋的,這有助於最小化結構變化。

鐵以鐵(III)的形式存儲在鐵蛋白中。 結合位點的確切性質尚未確定。 鐵似乎以水解產物的形式存在,例如FeO(OH)。 鐵由轉鐵蛋白運輸,轉鐵蛋白的結合位點由兩種酪氨酸,一種天冬氨酸和一種組氨酸組成[16] 。
骨橋蛋白參與骨骼和牙齒的細胞外基質的礦化。
金屬酶
金屬酶均具有一個共同的特徵,即金屬離子通過一個不穩定的配合位點與蛋白質結合。 與所有酶一樣,活性位點的形狀是至關重要的。 金屬離子通常被定位於形狀適合基底的口袋中。 金屬離子催化在有機化學中難以實現的反應。

- CO2 + H2O ⇌ H2CO3
在沒有催化劑的情況下該反應非常慢,但是在氫氧根離子的存在下該反應非常快
- CO2 + OH− ⇌ HCO−
3
碳酸酐酶幾乎可以立即進行類似的反應。碳酸酐酶中活性位點的結構從許多晶體結構中是眾所周知的。它由由三個組氨酸單元的三個咪唑氮原子配位的鋅離子組成。 第四配位位點被水分子占據。 鋅離子的配位球近似為四面體。帶正電的鋅離子使配位的水分子極化,並且帶負電的氫氧化物部分對二氧化碳(碳酸酐)的親核攻擊迅速進行。催化循環產生碳酸氫根離子和氫離子[2]作為化學平衡
- H2CO3 ⇌ HCO−
3 + H+
含鈷的維生素B12(也稱為鈷胺素)催化兩個分子之間的甲基(−CH3) 基團轉移,這涉及到C-C鍵的斷裂,該過程在有機反應中在能量上昂貴。 金屬離子通過形成瞬態Co−CH3鍵降低了該過程的活化能[18]。輔酶的結構被多蘿西·霍奇金(Dorothy Hodgkin)和同事確定了,為此她獲得了諾貝爾化學獎[19]。它由與咕啉環的四個氮原子和咪唑基團的第五個氮原子配位的鈷(II)離子組成。 在靜止狀態下,有一個帶有腺苷 5'碳原子的Co-C σ鍵[20]。這是一種天然存在的有機金屬化合物,解釋了其在反甲基化反應(例如蛋氨酸合酶進行的反應)中的功能。
固定大氣中的氮是一個非常耗能的過程,因為它涉及破壞氮原子之間非常穩定的三鍵。 固氮酶是可催化該過程的少數酶之一。該酶存在於根瘤菌細菌中。 其作用包括三個組成部分:活性位點上的鉬原子,參與運輸還原氮所需的電子的鐵硫簇,以及以鎂ATP形式存在的豐富能源。這最後組成部分是由細菌與宿主植物(通常是豆科植物)之間的共生關係提供的。 這種關係是共生的,因為植物通過光合作用提供能量,並通過獲得固定氮而受益。該反應可以象徵性地寫為
其中的Pi代表無機磷酸鹽。活性位點的確切結構很難確定。

葉綠素在光合作用中起着至關重要的作用。 它包含封閉在二氫卟吩環中的鎂。 但是,鎂離子並不直接參與光合作用,而是可以被其他二價離子所取代,而活性幾乎沒有損失。 相反,光子被二氫卟吩環吸收,其電子結構非常適合於此目的。

自從1980年代初期托馬斯·切赫(Thomas Cech)和西德尼·奧爾特曼(Sidney Altman)發現核酶以來,核酶已被證明是一類獨特的金屬酶[21]。 許多核酶在其活性位點需要金屬離子進行化學催化。 因此,它們被稱為金屬酶。另外,金屬離子對於核酶的結構穩定是必不可少的。第一組內含子是研究最多的核酶,它含有三種金屬參與催化[22]。 其他已知的核酶包括第二組內含子,RNase P和一些小的病毒核酶(例如錘頭,髮夾,HDV和VS)和核糖體的大亞基。 最近,已經發現了四類新的核酶(命名分別是 twister, twister sister, pistol and hatchet),它們都是自裂解核酶[23]。
脫氧核酶,也稱為DNA酶或催化性DNA,是人工催化的DNA分子,最早於1994年產生[24],此後迅速受到關注。 幾乎所有的DNA酶都需要金屬離子才能發揮作用。 因此,它們被分類為金屬酶。
信號轉導相關金屬蛋白

鈣調蛋白是信號轉導蛋白的一個例子。 它是一種小蛋白質,包含四個EF手模體,每個模體都可以結合Ca2+離子。
在EF手環中,鈣離子以五角雙錐體構型配位。 參與結合的六個穀氨酸和天冬氨酸殘基在多肽鏈的1、3、5、7和9位置。在位置12,有一個穀氨酸或天冬氨酸配體,表現為(雙齒配體),提供兩個氧原子。 由於骨架的構象要求,環中的第九個殘基必須是甘氨酸。 鈣離子的配位球僅包含羧酸氧原子而不包含氮原子。 這與鈣離子的硬性質是一致的。
該蛋白質具有兩個大致對稱的結構域,由柔性的「鉸鏈」區域隔開。 鈣的結合導致蛋白質中發生構象變化。 鈣調蛋白通過充當初始刺激的擴散性第二信使參與細胞內信號傳送系統[25][26]。
在心肌和骨骼肌中,肌肉力量的產生主要受細胞內鈣濃度變化的控制。 通常,當鈣增加時,肌肉收縮,而當鈣下降時,肌肉放鬆。 肌鈣蛋白與肌動蛋白和原肌球蛋白一起,是鈣與之結合以觸發肌肉力量產生的蛋白質複合物。

許多轉錄因子都包含一個稱為鋅指的結構,這是一個結構模體,其中蛋白質區域圍繞鋅離子摺疊。 鋅不直接接觸這些蛋白質結合的DNA。 相反,輔因子對於緊密摺疊的蛋白質鏈的穩定性至關重要[27]。 在這些蛋白質中,鋅離子通常由半胱氨酸和組氨酸側鏈對配位。
一氧化碳脫氫酶有兩種類型:一種包含銅和鉬,另一種包含鎳和鐵。 催化策略的平行和差異已被審查。[28] 根據所涉及的金屬,下表列出了一些其他金屬酶。
例子
參閱
參考文獻
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads