热门问题
时间线
聊天
视角
皮特森烯烴合成反應
来自维基百科,自由的百科全书
Remove ads
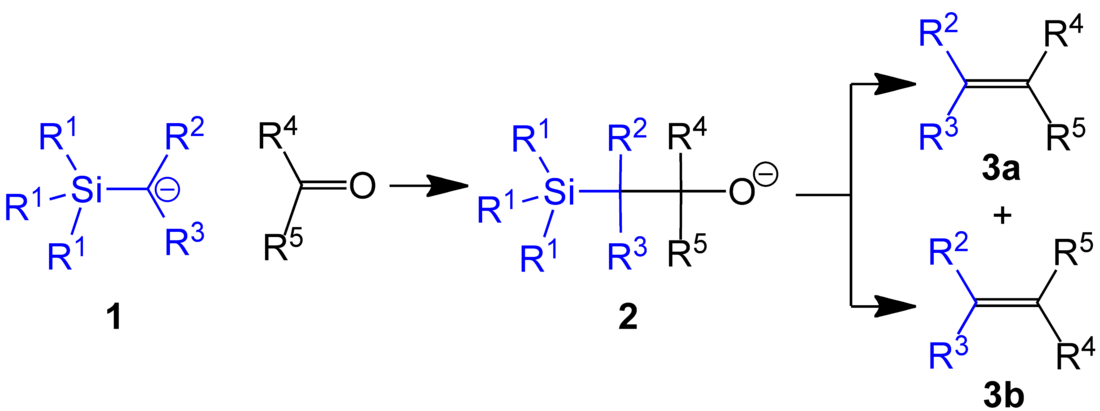
皮特森烯烴合成(Peterson反應)是α-硅基碳負離子(如格氏試劑)與醛酮加成生成β-羥基有機硅烷,而後發生消除生成烯烴的反應。[1] 反應綜述:[2][3][4][5]。

立體專一性是此反應的一個顯著特徵。同一條件下,用β-羥基硅烷的兩個非對映體分別發生消除,可以分別得到順式和反式的烯烴。此外,同一個β-羥基硅烷在酸和鹼介質中分別發生消除,也分別生成構型相反的烯烴。利用此性質可以控制產物烯烴的構型。
反應中不發生重排,具有很強的區域選擇性,可用於合成末端烯烴或環外烯烴。但酸性和鹼性的條件會使一些官能團受到破壞,比如雙鍵在酸作介質時會發生重排,使產率降低,從而限制了該反應的應用。對此有很多改進辦法。Chan等人的方法是用乙酰氯或氯化亞碸與羥基硅烷中間體反應,生成β-硅基酯,再使其在25°C發生分解,製取烯烴;[6] Corey等人是用α-硅基亞胺與醛酮反應,使中間體亞胺離子原位水解,一步製得烯烴。[7][8] Corey的方法也稱為Corey-Peterson反應。
Remove ads
反應機理
羥基硅烷在鹼作用下生成烷氧基負離子,進攻硅原子,形成四元環的中間體(推測),然後發生順式消除生成烯烴。
醇鹽作鹼時,醇鉀的反應速率最快,醇鈉其次,醇鎂最慢。這是因為氧原子的電子密度依次降低,親核性逐漸減弱的緣故。

酸作用下,羥基質子化,然後水作親核試劑,進攻硅原子,發生E2消除生成烯烴。過渡態中硅基與質子化的羥基呈反疊構象。

α-硅基碳負離子只含氫、烷基和供電子基時,中間體β-羥基硅烷比較穩定,可以在低溫下分離出來。對羥基硅烷的兩個非對映體進行拆分,然後用其中一個在酸作用下發生消除,另一個與鹼作用消除,產物是相同的。此法可以用來控制產物烯烴的雙鍵構型。[4][9]
酸催化下,硅基與羥基處於反式的異構體生成E型為主的產物烯烴,處於順式的異構體生成Z型為主的烯烴;鹼催化下,反式異構體主要生成Z型烯烴,順式異構體主要生成E型烯烴。

參見
- Horner-Wadsworth-Emmons反應
- Tebbe烯烴合成
- Wittig反應
- 化學反應列表
參考資料
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads